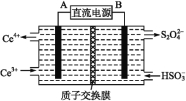
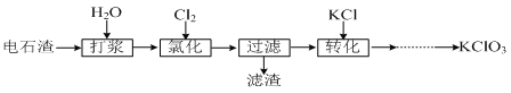
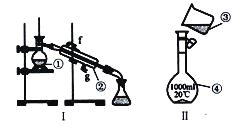
题目内容
【题目】A、B、C、D均为短周期元素。A、B可形成两种液态化合物甲和乙,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。Y溶于水能完全电离。已知X分子与乙分子中的电子数相等,Y分子与甲分子中的电子数相等。请回答:
(1)甲的电子式为___________。
(2)常温下,aL pH为2的Y溶液与bL pH为12的氢氧化钠溶液混合后,所得溶液pH=3,则a:b=___________。
(3)X溶于水后发生电离,写出电离方程式____________,已知X在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。请写出它的电离方程式:___________。
(4)X与甲在一定条件下可发生反应,生成无污染的产物,写出反应的化学方程式_________。
【答案】(1)![]() ;(2)11:9;
;(2)11:9;
(3)NH3·H2O![]() NH4++OH-;2NH3
NH4++OH-;2NH3![]() NH4++NH2-;
NH4++NH2-;
(4)2NH3+3H2O2![]() N2+6H2O
N2+6H2O
【解析】试题分析:A、B、C、D四种元素,由A、B可形成两种液态化合物,其最简式分别为BA和B2A,从A和B形成的化合物B2A,可知B的化合价为+1,A的化合价为-2,从而得出A为ⅥA 族元素,再从它能与B形成两种化合物可以确定,A只能为氧元素,B为氢元素;由B与D可形成一种极易溶于水的碱性气体X,中学阶段碱性气体只有氨气,故X为NH3,可知D为N元素;A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性,为NH4NO3;BA型液态化合物分子为H2O2,分子含有18个电子,B与C可形成极易溶于水的酸性气体Y,Y分子与BA型液态化合物分子中的电子数相等,故Y为HCl,C为Cl元素。
(1)甲为双氧水,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) pH=12的NaOH溶液中c(OH-)=![]() mol/L=0.01mol/L,pH=2的HCl溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=
mol/L=0.01mol/L,pH=2的HCl溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=![]() =0.001mol/L,解得a:b=11:9,故答案为:11:9;
=0.001mol/L,解得a:b=11:9,故答案为:11:9;
(3) X为NH3,NH3溶于水后发生电离,电离方程式为NH3·H2O![]() NH4++OH-,已知NH3在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。电离方程式为2NH3
NH4++OH-,已知NH3在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。电离方程式为2NH3![]() NH4++NH2-,故答案为:NH3·H2O
NH4++NH2-,故答案为:NH3·H2O![]() NH4++OH-;2NH3
NH4++OH-;2NH3![]() NH4++NH2-;
NH4++NH2-;
(4)NH3与H2O2在一定条件下可发生反应,生成无污染的产物水和氮气,反应的化学方程式为2NH3+3H2O2![]() N2+6H2O,故答案为:2NH3+3H2O2
N2+6H2O,故答案为:2NH3+3H2O2![]() N2+6H2O。
N2+6H2O。