题目内容
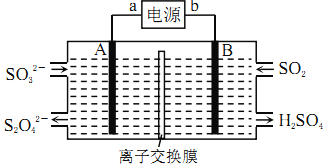
【题目】已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)NaHA溶液的pH___(填大于、小于或等于)Na2A溶液的pH。
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
【答案】小于 BC BD
【解析】
(1)H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-,第一步完全电离,HA-离子只存在电离不发生水解;
(2)混合溶液呈中性,则c(H+)=c(OH-),溶液中存在物料守恒和电荷守恒,注意离子积常数只与温度有关;
(3)根据影响沉淀溶解平衡移动的因素有温度和浓度分析判断。
(1)H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-,第一步完全电离,HA-离子只存在电离不发生水解,溶液显酸性,Na2A溶液中A2-离子水解显碱性,所以NaHA溶液的pH小于Na2A溶液的pH,故答案为:小于;
(2)A.水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数未知,故A错误;B.溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HA-)+2c(A2-),故B正确;C.NaHA溶液呈酸性,Na2A溶液显碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;D.Na2A溶液显碱性,向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHA的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;故答案为:BC;
(3)CaA(s)Ca2+(aq)+A2-(aq)△H>0,降低温度,平衡逆向移动,c(Ca2+)减小,加入NH4Cl晶体,铵根离子与A离子水解相互促进,平衡正向移动,钙离子浓度增大,加入Na2A固体,A2-离子浓度增大,平衡逆向移动,c(Ca2+)减小,故答案为:BD。

【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。