题目内容
已知下列离子在酸性条件下都能氧化KI,它们自身发生如下变化:① Cr2O72-→ Cr3+,②IO3-→ I2,③MnO4-→ Mn2+。如果分别用等物质的量的这些离子氧化足量的KI,得到I2的物质的量由多到少的顺序正确的是
| A.②=③>① | B.①>②=③ | C.②>③>① | D.①=②>③ |
D
解析试题分析:根据氧化还原反应中得失电子守恒可知,在3个反应中氧化剂不一样,而还原剂均为碘化钾中的碘离子,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的也就是比较每1mol氧化剂得电子的多少,谁得电子多谁氧化的KI多,生成的I2就多。①Cr2O72-→ Cr3+得6mole-,生成3mol单质碘。②IO3-→ I2得5mole-,但由于还原产物也是单质碘,所以共得到2.5mol+0.5mol=3mol单质碘。③1molMnO4-→Mn2+得5mole-,得到2.5mol单质碘,1mol氧化剂参加反应生成的I2是①=②>③,答案选D。
考点:考查氧化还原反应的计算

下列类型的反应,一定发生电子转移的是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是 ( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在潮湿的空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
下列说法正确的是
| A.氧化剂得电子数越多其氧化能力越强 | B.发生化学键断裂的过程不一定发生化学反应 |
| C.常温下所有的吸热反应都不能自发进行 | D.两种难溶物溶解度小的物质其Ksp一定也小 |
现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
| A.+4 | B.+3 | C.+2 | D.+1 |
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为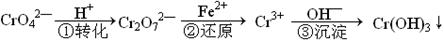
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O下列说法错误的是
Cr2O72—(橙色)+H2O下列说法错误的是
| A.在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B.溶液的pH值不变时,说明第①步反应达平衡状态 |
| C.第②步中,还原0.01mol Cr2O72—离子,需要0.06mol的FeSO4·7H2O。 |
| D.上述三步转化反应中,只有一个反应为氧化还原反应 |
下列关于氧化还原反应的说法,正确的是
| A.氧化还原反应的特征是电子的转移 |
| B.氧化剂在反应中被还原,生成氧化产物 |
| C.同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数 |
| D.任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是 ( )。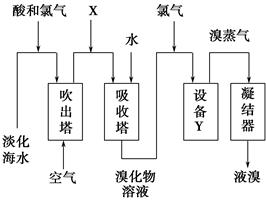
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下) |