题目内容
某研究性小组为探究铜跟浓
硫酸的反应情况,设计了如图所示装置进行有关实验:实验中他们取6.4g铜片与12mL18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中有铜剩余.
(1)写出铜跟浓硫酸反应的化学方程式:______.
(2)该小组认为还应有一定量的硫酸剩余.请说明铜片未完全溶解并仍有一定量余酸的原因:______.
(3)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的______(填写字母编号).
A.铁粉B.BaCl2溶液C.银粉D.Na2CO3溶液.
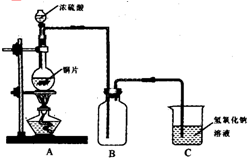
硫酸的反应情况,设计了如图所示装置进行有关实验:实验中他们取6.4g铜片与12mL18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中有铜剩余.
(1)写出铜跟浓硫酸反应的化学方程式:______.
(2)该小组认为还应有一定量的硫酸剩余.请说明铜片未完全溶解并仍有一定量余酸的原因:______.
(3)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的______(填写字母编号).
A.铁粉B.BaCl2溶液C.银粉D.Na2CO3溶液.

(1)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2)金属铜活泼性在氢之后,不能够与稀硫酸反应,浓硫酸具有强氧化性,能将铜等不活泼金属氧化,本身被还原成二氧化硫,所以铜能够与浓硫酸反应,反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应,所以铜片未完全溶解并仍有一定量余酸,
故答案为:反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应;
(3)稀硫酸是强电解质硫酸的稀溶液,电离出氢离子和硫酸根离子,所以为证明反应结束后的烧瓶中确有余酸,需检验氢离子,用铁粉检验氢离子的存在,铁和氢离子反应生成氢气能检验;BaCl2溶液和硫酸根离子反应生成沉淀,无酸剩余时,溶液中存在硫酸根离子,无法证明氢离子存在,不能检验;金属银活泼性在氢之后,不能够与稀硫酸反应,不能检验;Na2CO3溶液电离出的碳酸根离子和氢离子反应生成二氧化碳和水,所以能检验,
故答案为:AD.
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(2)金属铜活泼性在氢之后,不能够与稀硫酸反应,浓硫酸具有强氧化性,能将铜等不活泼金属氧化,本身被还原成二氧化硫,所以铜能够与浓硫酸反应,反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应,所以铜片未完全溶解并仍有一定量余酸,
故答案为:反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应;
(3)稀硫酸是强电解质硫酸的稀溶液,电离出氢离子和硫酸根离子,所以为证明反应结束后的烧瓶中确有余酸,需检验氢离子,用铁粉检验氢离子的存在,铁和氢离子反应生成氢气能检验;BaCl2溶液和硫酸根离子反应生成沉淀,无酸剩余时,溶液中存在硫酸根离子,无法证明氢离子存在,不能检验;金属银活泼性在氢之后,不能够与稀硫酸反应,不能检验;Na2CO3溶液电离出的碳酸根离子和氢离子反应生成二氧化碳和水,所以能检验,
故答案为:AD.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 的叙述中,不正确的是( )
的叙述中,不正确的是( )
