题目内容
在100mL 2.00mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1.00,求产生的沉淀的质量,以及NaHSO4溶液的物质的量浓度(设两种溶液混合时体积变化忽略不计)。
反应后溶液的pH是1,所以反应后溶液中的氢离子浓度是0.1mol/L,物质的量为0.1mol.L×0.2L=0.02mol。反应的方程式为:
2NaHSO4+Ba(OH)2=Na2SO4+2H2O+BaSO4↓
2mol 1mol 1mol
0.4mol 0.2mol 0.2mol
所以硫酸氢钠的物质的量是0.4mol+0.02mol=0.42mol
浓度为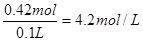
硫酸钡的物质的量是0.2mol
所以质量是0.2mol×233g/mol=46.6g
2NaHSO4+Ba(OH)2=Na2SO4+2H2O+BaSO4↓
2mol 1mol 1mol
0.4mol 0.2mol 0.2mol
所以硫酸氢钠的物质的量是0.4mol+0.02mol=0.42mol
浓度为
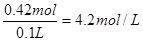
硫酸钡的物质的量是0.2mol
所以质量是0.2mol×233g/mol=46.6g
考查pH的有关计算,氢氧化钡和硫酸氢钠混合后会发生反应,根据溶液的pH是1,可知硫酸氢钠是过量的,然后根据方程式列式进行计算即可。

练习册系列答案
相关题目