题目内容
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行氯化镁溶液龟解实验,电解装置如图所示。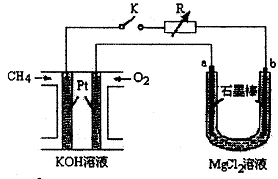
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为: 。
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的气体可用 检验,b电极上得到的气体是 ,电解氯化镁溶液的离子方程式为 。
(3)若甲烷通入量为1.12 L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为 ,产生的氯气体积为 L(标准状况)。
(4)已知常温常压下,0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,请写出CH4燃烧热的热化学方程式 。
已知;①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
计算:C(石墨)与H2(g)反应生成1molCH4(g)的△H= 。
(1)CH4+ 10OH――8e- = CO32-+7H2O
(2)湿润的淀粉碘化钾试纸 氢气 Mg2++2Cl-+2H2O = Mg(OH)2+ H2↑+Cl2↑
(3)0.4mol 4.48L
(4)CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H= -890kJ/mol -75.1kJ/mol
解析试题分析:该装置中左边是原电池,右边是电解池,a为阳极,b为阴极。(1)甲烷在碱性条件下失去电子,电极反应式为CH4+ 10OH――8e- = CO32-+7H2O;(2)a极产生氯气,用湿润的淀粉碘化钾试纸检验;b极H+放电,产生氢气,电解方程式为Mg2++2Cl-+2H2O = Mg(OH)2+ H2↑+Cl2↑;
(3)n(e-)=1.12÷22.4×8=0.4mol v(Cl2)=0.4÷2×22.4=4.48L
(4)0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,
1molCH4完全燃烧放出热量为222.5×4=890kJ,燃烧热热化学方程式为
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H= -890kJ/mol
△H=△H1+△H2-甲烷燃烧热=-75.1kJ/mol
考点:考查化学反应中能量变化有关问题。

某化学兴趣小组拟采用下图所示装置电解饱和氯化钠溶液制备H2,通过H2还原氧化铜测定Cu的相对原子质量Ar(Cu),同时检验Cl2的氧化性(图中夹持和加热仪器已略去)。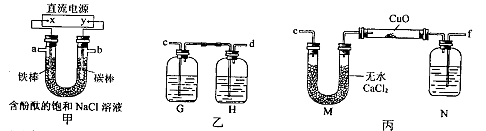
(1)直流电源中的X极为 极(填“正”、“负”、“阴”或“阳”);写出甲装置U形管中反应的离子方程式: ;实验开始后,用铁棒作电极的一侧的实验现象是 。
(2)为完成上述实验,正确的链接顺序为:a连 ,b连 (填写连接的字母)。
(3)装置乙中的G瓶内溶液可能为 (填字母)。
| A.淀粉KI溶液 | B.NaOH溶液 | C.Na2S溶液 | D.Na2SO3溶液 |
(4)在对硬质玻璃试管里的氧化铜粉末加热前需要进行的操作为: 。
(5)装置丙中N瓶内盛放的试剂为 ,作用是 。
(6)为了测定Cu的相对原子质量,某同学通过实验测得如一下数据:
I.氧化铜样品质量为m1g
Ⅱ.反应后硬质玻璃管中剩余固体质量为m2g
Ⅲ.反应前后U形管及其固体质量差为m3g
Ⅳ.反应前后瓶及其液体质量差为m4g
①请选择理论上误差最小的一组数据计算Ar(Cu),Ar(Cu)= 。
②如果选用其它数据进行计算,会导致Ar(Cu) (填“偏大”、“偏小”或“无影响”),理由是 。

 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
 。
。 =-2830kJ·mol-1
=-2830kJ·mol-1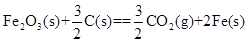

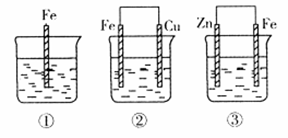

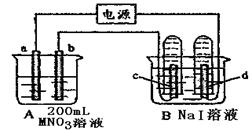
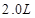 ,
, 溶液,如有
溶液,如有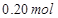 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题: 的质量是 ,得到
的质量是 ,得到 的体积(标准状况)是 。
的体积(标准状况)是 。 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)