题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.反应5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4LN2时转移的电子数为3.75NA
B.1 mol浓硫酸与足量Mg完全反应,转移电子数可能为NA
C.标准状况下甲烷(CH4)和氧气(氧气充足)的混合气体共22.4L,完全燃烧后产物的分子总数一定为NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
【答案】C
【解析】
A. 此反应转移15mol电子时生成4mol氮气,若生成标况下22.4LN2,即1mol氮气时,转移的电子的物质的量为3.75mol,由于题目没有指明温度和压强,无法计算出氮气的物质的量,故无法计算转移的电子数,故A错误;
B.镁和浓硫酸反应生成硫酸镁、二氧化硫和水:Mg+2H2SO4![]() MgSO4+2H2O+SO2↑,此反应中2mol浓硫酸转移2mol电子,故若1mol浓硫酸全部发此反应,则转移1mol电子;镁和稀硫酸反应Mg+H2SO4=MgSO4+H2↑,此反应中,1mol硫酸转移2mol电子,而将足量镁投入到1mol浓硫酸中,镁先和浓硫酸反应后和稀硫酸反应,故转移的电子数介于NA到2NA之间,不可能是NA个,故B错误;
MgSO4+2H2O+SO2↑,此反应中2mol浓硫酸转移2mol电子,故若1mol浓硫酸全部发此反应,则转移1mol电子;镁和稀硫酸反应Mg+H2SO4=MgSO4+H2↑,此反应中,1mol硫酸转移2mol电子,而将足量镁投入到1mol浓硫酸中,镁先和浓硫酸反应后和稀硫酸反应,故转移的电子数介于NA到2NA之间,不可能是NA个,故B错误;
C.甲烷完全燃烧的化学方程式为CH4+2O2![]() CO2+2H2O,反应前后气体的分子数不变,条件为标准状态,因此1mol此混合气体燃烧后产物分子总数为NA,故C正确;
CO2+2H2O,反应前后气体的分子数不变,条件为标准状态,因此1mol此混合气体燃烧后产物分子总数为NA,故C正确;
D. 10gD2O物质的量=![]() =0.5mol,0.5mol分子中含有的质子数与中子数均为5NA,故D错误;
=0.5mol,0.5mol分子中含有的质子数与中子数均为5NA,故D错误;
故选C。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
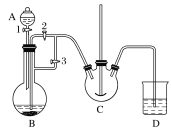
暑假作业北京艺术与科学电子出版社系列答案【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是

①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同