题目内容
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
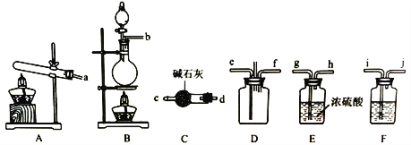
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的离子方程式____________
(2)确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置F中试剂的作用为___________
(4)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化铵固体可能会堵塞导管,之二为:___________。
II.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用右图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。
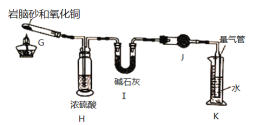
(5)写出G中发生反应的方程式______________________________________________
(6)若没有H装置,会导致测量值_____________(填“偏高”,“偏低”或“无影响”)。
【答案】MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O →dchg←ji←b 除Cl2中的HCl无尾气处理装置2NH4Cl+3CuO
Mn2++Cl2↑+2H2O →dchg←ji←b 除Cl2中的HCl无尾气处理装置2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O偏低
3Cu+N2↑+2HC1↑+3H2O偏低
【解析】
I(1)实验室采用二氧化锰和浓盐酸在加热条件下制备氯气,离子反应方程式为:MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置A为制备氨气,装置B用于制备氯气,装置C用于干燥氨气,装置D用于氨气与氯气混合,因为氯气的密度比氨气的大,所以e口通氨气,f口通氯气,装置E用于干燥氯气,装置F用于除去制备氯气中的氯化氢杂质,因此应放饱和食盐水,所以连接顺序应为→dc →ef← hg←ji←b;
(3)实验室采用二氧化锰和浓盐酸在加热条件下制的备氯气中混有氯化氢气体,应先除去氯化氢杂质,装置F用于除去氯气中的氯化氢杂质;
(4)氯气有毒,需要进行尾气处理,可采用氢氧化钠溶液吸收尾气,因此本实验还缺少尾气处理装置;
II(5)根据题意可知反应物为氯化铵和氧化铜,反应后产生红色固体应为铜单质,产生不溶于水的无色气体应为氮气,根据化学反应中得失电子守恒和质量守恒可知反应方程式为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O;
3Cu+N2↑+2HC1↑+3H2O;
(6)浓硫酸用于吸收产生的水,而氯化氢和水均能被碱石灰吸收,如果没有浓硫酸会导致测定氯化氢质量偏大,氯元素质量偏高,因此导致测定氮元素质量偏低,最终导致氮元素和氯元素的质量之比偏低。

 阅读快车系列答案
阅读快车系列答案