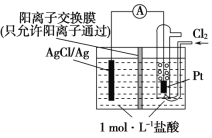
题目内容
【题目】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是________(填序号)。
① 配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④ 加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
⑥ 由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。其作用原理为__________________。
(3)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
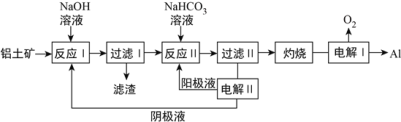
①滤渣主要成分为___________________
②在实验室灼烧操作应选择的实验仪器为_____________________
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式________。
(4)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038, Ksp[Al(OH)3]=1.1×1033。
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
【答案】①④⑤ K2FeO4中+6价铁具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质,起到净水作用 Fe2O3 坩埚 HCO3-+OH-=H2O+CO32- Al(OH)3 不含有
【解析】
(1) ①配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,防止三价铁离子水解,再用蒸馏水稀释到所需的浓度,故①正确;
②FeCl2可以通过置换反应生成,也可以通过化合反应生成,如铁与FeCl3反应生成FeCl2,FeCl3只能通过化合反应生成,故②错误;
③Fe3+能使KSCN溶液变为血红色,所以不能利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+,故③错误;
④Fe2(SO4)3水解得到硫酸不挥发 (硫酸沸点比水高),就算能生成H2SO4 ,也会和Fe(OH)3反应,所以都得到了原固体,故④正确;
⑤a mol AlCl3 1.5a mol NaOH的物质的量之比为2:3,AlCl3过量,所以无论正滴和反滴,生成Al(OH) 3的质量相等
(2) K2FeO4中+6价铁具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质,起到净水作用;
(3) ①铝土矿(主要成分为Al2O3和Fe2O3、SiO2)中Fe2O3不溶于氢氧化钠溶液,所以滤渣主要成分为Fe2O3;②灼烧操作应选择的实验仪器是坩埚;③在溶解铝土矿时加入了过量的氢氧化钠溶液,所以加入NaHCO3先与未反应的氢氧根反应,离子方程式为HCO3-+OH-=H2O+CO32-;
(4) ①根据25 ℃时,氢氧化铜与氢氧化铝的溶度积常数Ksp[Cu(OH)2]=2.2×1020, Ksp[Al(OH)3]=1.1×1033,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,
![]() ,滴加相同浓度的氨水,Al(OH)3先析出;
,滴加相同浓度的氨水,Al(OH)3先析出;
②Fe3+完全沉淀时,c(OH-)3= Ksp[Fe(OH)3]/c(Fe3+)=4.0×1038÷(1.0×105) =4.0×1033,则c(Al3+).c(OH-)3=0.2×4.0×1033=8×1034<Ksp[Al(OH)3]=1.1×1033,所以没有生成Al(OH)3沉淀。

 阳光试卷单元测试卷系列答案
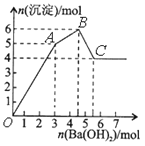
阳光试卷单元测试卷系列答案【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-