题目内容
【题目】一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
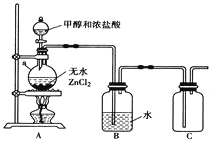
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为_________________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________________。
③装置B的主要作用是_________________。
④若将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1Na OH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。则所收集CH3C1的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①将甲组装置制备的CH3Cl气体通过盛有酸性KMnO4溶液的洗气瓶,如果观察到溶液中__________,则说明CH3Cl比CH4分子稳定性弱。
②实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为________________。
(3)丙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
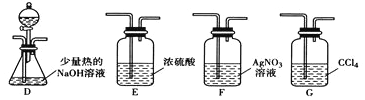
①丙组同学的实验装置中,依次连接的合理顺序为A、B、_________。
②D中分液漏斗中盛放的试剂是硝酸酸化的硝酸银溶液。通入一段时间的CH3Cl气体后,打开分液漏斗的活塞,观察实验现象,能证明CH3Cl中含有氯元素的实验现象是______________________。
【答案】 圆底烧瓶 CH3OH+HCl(浓) ![]() CH3Cl+H2O 在HC1气流中小心加热 除去HC1、CH3OH气体 (c1V1-c2V2)×10-3 紫色褪去 l0CH3Cl+14MnO4-+42H+→10CO2↑+5Cl2↑+14Mn2++36H2O F、D、G F中无白色沉淀生成,D中有白色沉淀生成
CH3Cl+H2O 在HC1气流中小心加热 除去HC1、CH3OH气体 (c1V1-c2V2)×10-3 紫色褪去 l0CH3Cl+14MnO4-+42H+→10CO2↑+5Cl2↑+14Mn2++36H2O F、D、G F中无白色沉淀生成,D中有白色沉淀生成
【解析】试题分析:本题以一氯甲烷的制备和氯元素的检验为载体,主要考查醇类的取代反应原理、盐类水解、滴定反应的计算、卤代烃中卤原子的检验等知识,考查考生对滴定原理的理解能力,考查考生的检验实验设计能力。
解析:(1)①甲醇与浓盐酸可以发生取代反应生成一氯甲烷,反应原理为CH3OH+HCl ![]() CH3Cl+H2O。正确答案:圆底烧瓶、CH3OH+HCl
CH3Cl+H2O。正确答案:圆底烧瓶、CH3OH+HCl ![]() CH3Cl+H2O。②用干燥ZnCl2晶体制备无水ZnCl2过程中,主要防止在加热除去结晶水同时ZnCl2会发生水解反应,可以不断通入干燥的HCl抑制ZnCl2的水解并带出水蒸气。正确答案:在HC1气流中小心加热。③从A装置中导出的气体中含有CH3Cl、CH3OH、HCl、H2O,B装置盛放的水可以溶解除去CH3OH、HCl及大部分水蒸气。正确答案:除去CH3OH、HCl。④设收集到的CH3Cl为xmol,反应生成CO2xmol,HClxmol,NaOH吸收过程中消耗NaOH 2x+x=3xmol,剩余NaOH 10-3×c1v1-3xmol。用甲基橙作指示剂滴定时,反应生成的Na2CO3生成CO2,则10-3×c1v1-3xmol+ 2x=10-3×c2v2,x=10-3×(c1v1-c2v2)。正确答案:10-3×(c1v1-c2v2) 。
CH3Cl+H2O。②用干燥ZnCl2晶体制备无水ZnCl2过程中,主要防止在加热除去结晶水同时ZnCl2会发生水解反应,可以不断通入干燥的HCl抑制ZnCl2的水解并带出水蒸气。正确答案:在HC1气流中小心加热。③从A装置中导出的气体中含有CH3Cl、CH3OH、HCl、H2O,B装置盛放的水可以溶解除去CH3OH、HCl及大部分水蒸气。正确答案:除去CH3OH、HCl。④设收集到的CH3Cl为xmol,反应生成CO2xmol,HClxmol,NaOH吸收过程中消耗NaOH 2x+x=3xmol,剩余NaOH 10-3×c1v1-3xmol。用甲基橙作指示剂滴定时,反应生成的Na2CO3生成CO2,则10-3×c1v1-3xmol+ 2x=10-3×c2v2,x=10-3×(c1v1-c2v2)。正确答案:10-3×(c1v1-c2v2) 。
(2)①如果CH3Cl分子比CH4更加活泼,则CH3Cl能够被酸性KMnO4溶液氧化,酸性KMnO4溶液被还原而褪色。正确答案:紫色褪去。②生成的黄绿色气体是Cl2,同时C被氧化生成CO2,即反应基础理解为CH3Cl+KMnO4 →Cl2↑+CO2↑+MnSO4,配平得l0CH3Cl+14MnO4-+42H+→10CO2↑+5Cl2↑+14Mn2++36H2O。正确答案:l0CH3Cl+14MnO4-+42H+→10CO2+5Cl2+14Mn2++36H2O。(3)由于A中导出的气体含有CH3Cl、HCl等物质,通过B除去HCl后还需要证明HCl已经完全除尽,所以先通过F装置检验不存在HCl气体。CH3Cl中的Cl元素无法直接检验,所以需要通过卤代烃的水解反应或消去反应首先转变成Cl-,然后加硝酸酸化后用AgNO3检验Cl-。最后气体中没有反应的CH3Cl通过G中的CCl4吸收,防止污染空气。当F溶液中没有白色沉淀,且D最终有白色沉淀时可以证明卤代烃中含有Cl元素。正确答案:FDG、F中无白色沉淀生成,D中有白色沉淀生成。