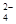题目内容
常温下,关于下列溶液的叙述错误的是
| A.CH3COOH分子可以存在于pH=8的碱性溶液中 |
| B.1mol/L氨水与0.5mol/L氨水中c(OH-)之比是2:1 |
| C.甲酸溶液和一定量NaOH溶液恰好完全反应,溶液中c(HCOO-)<c(Na+) |
| D.等体积等pH的醋酸和盐酸分别加水稀释至a mL和b mL,稀释后溶液pH均为5,则a>b |
B
试题分析:A选项CH3COOH在碱性溶液中会和碱性物质发生酸碱中和反应,但醋酸是弱电解质,反应得到的盐又会发生水解生成CH3COOH分子,故CH3COOH分子可以存在于pH=8的碱性溶液中。B选项氨水是弱电解质,在溶液中不完全电离,同时在稀溶液中的电离程度大,故1mol/L氨水与0.5mol/L氨水中c(OH-)之比小于2:1。C选项要使甲酸和NaOH溶液恰好完全反应,则甲酸和NaOH的物质的量应相等,反应后生成甲酸钠,甲酸根离子发生水解,所以溶液中c(HCOO-)<c(Na+)。D选项醋酸在稀释时还会发生电离,故要将等体积等pH的醋酸和盐酸分别加水稀释,稀释后溶液pH相等,则稀释醋酸所需要的水更多。
点评:本题从弱电解质的不完全电离出发,考察了其在稀释和与强电解质反应方面的问题,需要学生分析清楚各个反应的过程,是对弱电解质知识的综合运用。

练习册系列答案
相关题目
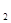 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )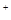 、Fe
、Fe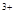 、SO
、SO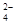 、Cl
、Cl
 、Mg
、Mg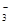 、NO
、NO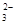
 、OH
、OH