题目内容
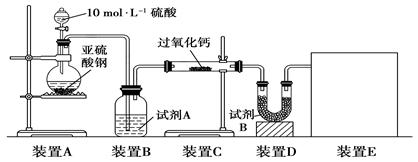
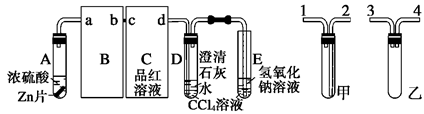
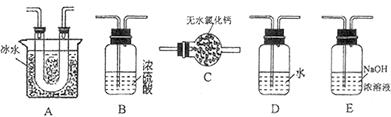
(14分)某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
试回答:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:____________________________________。
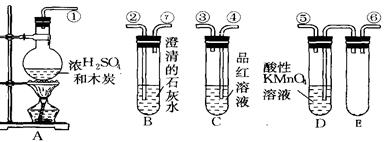
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是______________________________________________。
(3) ①能证明浓硫酸具有强氧化性的实验现象为____________________________________;
②反应较长时间后气泡量又会明显增加的原因是_______________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。

试回答:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:____________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是______________________________________________。
(3) ①能证明浓硫酸具有强氧化性的实验现象为____________________________________;
②反应较长时间后气泡量又会明显增加的原因是_______________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
(1)Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O Zn+H2SO4(稀)===ZnSO4+H2↑
(2)3或4 4或3 2 1 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4后,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
(2)3或4 4或3 2 1 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4后,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
(1)浓硫酸和锌反应生成硫酸锌、SO2和水。但随着反应的进行,硫酸的浓度逐渐降低,因此最后会生成氢气和硫酸锌,反应的方程式分别是Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O、Zn+H2SO4(稀)===ZnSO4+H2↑。
(2)由于SO2极易溶于水,所以B处应该是防倒吸的装置,所以选择是乙装置;C处是检验SO2的漂白性的,所以选择甲装置,因此正确的连接顺序是3或4 4或3 2 1。由于SO2极易溶于水,而四氯化碳的密度不溶于水,且在水的下层,所以D、E两支试管中CCl4溶液的作用是防倒吸。
(3)①证明浓硫酸具有强氧化性,数目反应中有SO2生成,因此现象是C中品红溶液褪色。
②随着反应的进行,浓H2SO4变成稀H2SO4后,与Zn反应放出H2,所以气体又逐渐增加。
(4)由于过量的SO2能和亚硫酸钙反应生成亚硫酸氢钙,因此又变澄清,反应的方程式是SO2+H2O+CaSO3===Ca2++2HSO。
(2)由于SO2极易溶于水,所以B处应该是防倒吸的装置,所以选择是乙装置;C处是检验SO2的漂白性的,所以选择甲装置,因此正确的连接顺序是3或4 4或3 2 1。由于SO2极易溶于水,而四氯化碳的密度不溶于水,且在水的下层,所以D、E两支试管中CCl4溶液的作用是防倒吸。
(3)①证明浓硫酸具有强氧化性,数目反应中有SO2生成,因此现象是C中品红溶液褪色。
②随着反应的进行,浓H2SO4变成稀H2SO4后,与Zn反应放出H2,所以气体又逐渐增加。
(4)由于过量的SO2能和亚硫酸钙反应生成亚硫酸氢钙,因此又变澄清,反应的方程式是SO2+H2O+CaSO3===Ca2++2HSO。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目

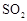 转化为
转化为 的转化率测定实验:
的转化率测定实验: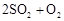

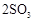 ;
;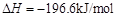 。已知:
。已知: )
)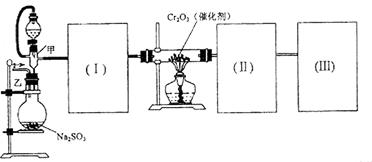
 ,为使
,为使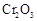 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有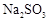 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入