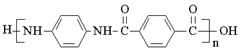题目内容
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体 ②液态HCl ③CO2 ④汞 ⑤CaCO3固体 ⑥稀硫酸 ⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水
其中属于混合物的是(填序号,下同)___;属于电解质的是___;属于非电解质的是___;能导电的有____。
(2)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
①将1mol·L-1的FeCl3 溶液逐滴滴入沸水中,液体变为__色,得到的是Fe(OH)3胶体;反应的化学方程式为____。
②怎样证明制得的物质是胶体?请简述操作过程:____。
③取少量制得的胶体加入试管中,再加入少量NaCl溶液,观察到的现象是__,这种现象称为胶体的____。
④Fe(OH)3胶体能稳定存在的主要原因是___(填序号)。
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶体离子作无规则运动(即布朗运动) D.胶粒能透过滤纸
【答案】⑥⑨ ①②⑤⑧ ③⑦ ④⑥⑧⑨ 红褐 FeCl3+3H2O![]() Fe(OH)3(胶体)+ 3HCl 利用丁达尔效应;让一束光线通过制得的物质,从侧面观察可看到一条光亮的“通路”,说明制得的物质是胶体 产生红褐色沉淀 聚沉 B
Fe(OH)3(胶体)+ 3HCl 利用丁达尔效应;让一束光线通过制得的物质,从侧面观察可看到一条光亮的“通路”,说明制得的物质是胶体 产生红褐色沉淀 聚沉 B
【解析】
(1)⑥稀硫酸是硫酸的水溶液;⑨浓氨水氨气的水溶液;其中属于混合物的是 ⑥⑨;
①KCl晶体、②液态HCl、⑤CaCO3固体、⑧熔融的NaCl在水溶液里能电离出自由移动的离子,属于电解质;属于电解质的是①②⑤⑧;
③二氧化碳的水溶液能导电,原因是二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,二氧化碳是非电解质;⑦酒精在水溶液里或熔融状态下都不导电,属于非电解质,属于非电解质的是③⑦;
④汞有能自由移动的自由电子;⑥稀硫酸中有氢离子和硫酸根离子;⑧熔融的NaCl电离成氯离子和钠离子;⑨浓氨水中有铵根离子和氢氧根离子;能导电的有④⑥⑧⑨。
(2)①将1mol·L-1的FeCl3 溶液逐滴滴入沸水中,液体变为红褐色,得到的是Fe(OH)3胶体;反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+ 3HCl。
Fe(OH)3(胶体)+ 3HCl。
②利用丁达尔效应;让一束光线通过制得的物质,从侧面观察可看到一条光亮的“通路”,说明制得的物质是胶体。
③胶粒带正电荷,取少量制得的胶体加入试管中,再加入少量NaCl溶液,溶液中的氯离子带负电,正负电荷作用,观察到产生红褐色沉淀 ,这种现象称为胶体的聚沉。
④Fe(OH)3胶体能稳定存在的主要原因是胶粒带正电荷,粒子之间相互作用,不形成沉淀。故选B。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案