题目内容
(1)室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为 10(填大于、等于或小于).
(2)室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为 ,在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,加水稀释到10L,所发生反应的离子方程式为 ,pH为 .
(2)室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为
考点:弱电解质在水溶液中的电离平衡,离子方程式的书写,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)相同温度下,一水合氨溶液浓度越小,其电离程度越大;
(2)硫酸氢钠电离方程式NaHSO4=Na++H++SO42-,所以溶液中c(H+)=c(NaHSO4)=0.01mol/L,据此计算溶液的pH;在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,二者的物质的量相等,二者反应生成硫酸钡、NaOH和水,根据钠原子守恒计算溶液中C(NaOH),再计算溶液的pH.
(2)硫酸氢钠电离方程式NaHSO4=Na++H++SO42-,所以溶液中c(H+)=c(NaHSO4)=0.01mol/L,据此计算溶液的pH;在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,二者的物质的量相等,二者反应生成硫酸钡、NaOH和水,根据钠原子守恒计算溶液中C(NaOH),再计算溶液的pH.
解答:
解:(1)相同温度下,一水合氨溶液浓度越小,其电离程度越大,所以甲、乙两瓶氨水中C(OH-)之比为小于10,故答案为:小于;
(2)硫酸氢钠电离方程式NaHSO4=Na++H++SO42-,所以溶液中c(H+)=c(NaHSO4)=0.01mol/L,溶液的pH=2;在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,二者的物质的量相等,二者反应生成硫酸钡、NaOH和水,离子方程式为SO42-+Ba2++H++OH-=BaSO4↓+H2O,根据钠原子守恒计算溶液中C(NaOH)=
=0.001mol/L,c(H+)=
mol/L=10-11 mol/L,溶液的pH=11,
故答案为:2;SO42-+Ba2++H++OH-=BaSO4↓+H2O;11.
(2)硫酸氢钠电离方程式NaHSO4=Na++H++SO42-,所以溶液中c(H+)=c(NaHSO4)=0.01mol/L,溶液的pH=2;在其中滴入等体积的0.01mol?L-1的Ba(OH)2溶液后,二者的物质的量相等,二者反应生成硫酸钡、NaOH和水,离子方程式为SO42-+Ba2++H++OH-=BaSO4↓+H2O,根据钠原子守恒计算溶液中C(NaOH)=
| 0.01mol/L×1L |
| 10L |
| 10-14 |
| 10-3 |
故答案为:2;SO42-+Ba2++H++OH-=BaSO4↓+H2O;11.
点评:本题考查了弱电解质的电离、pH的计算,根据弱电解质电离程度与溶液浓度的关系、pH的计算方法等知识点来分析解答,注意根据硫酸氢钠和氢氧化钡的量确定产物,为易错点.

练习册系列答案
相关题目
下列与有机物的结构、性质有关的叙述正确的是( )
| A、乙烯和聚乙烯都可以与溴水发生加成反应 |
| B、醇与所有酸的反应都是酯化反应 |
| C、乙烷与氯气发生取代反应生成的有机物共有9种 |
| D、在有机物分子中,两个羟基去掉一分子水的反应就是酯化反应 |
相同温度下,在水中分别加入下列物质,若用KW表示水的离子积,α表示水的电离度,能使
的值增大的是( )
| α |
| KW |
| A、NaOH |
| B、NaHSO4 |
| C、NH4NO3 |
| D、KCl |
下列关系中,正确的是( )
| A、原子半径:Mg>K |
| B、非金属性:O<S |
| C、稳定性:HCl>HBr |
| D、碱性:NaOH>KOH |
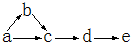 a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.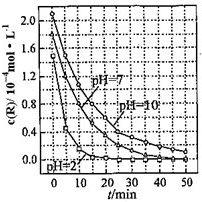 一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题:
一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题: