��Ŀ����
����Ŀ����ͼ��ʾ���������̶��������������������ƶ���M��N���������о�������Ӧ��N2��g��+3H2��g�� 2NH3��g����H=��192kJmol��1���� M��N �У���ͨ�� xmol N2 ��ymol H2�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ���� �� ��

A. ��x��y=1��2����ƽ��ʱ��M�е�ת���ʣ�N2��H2
B. ��x��y=1��3����M�зų�����172.8kJʱ��N2��ת����Ϊ90%
C. ��x=1��y=3����ﵽƽ��ʱ��Ӧ���ת����N��M
D. ƽ��ʱN2����������������������������
���𰸡�CD
��������M�������ֺ��ݣ�N�������ֺ�ѹ�����ڷ�Ӧǰ�������ϵ���Ͳ��ȣ���������ƽ��̬Ҳ��һ����A��x��y=1��2����y=2 x���跴Ӧ�����ĵ�amolN2����
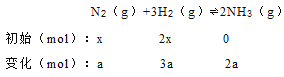
��N2��ת����=a/x��H2��ת����=3a/2x����ƽ��ʱ��M�е�ת���ʣ�N2��H2����A����B����Ŀ���Ȼ�ѧ����ʽ�����壺��1moN2l��ȫ��Ӧ������192 kJ����M�зų�����172.8kJʱ���μӷ�Ӧ��N2�����ʵ���Ϊ172.8kJ��1mol/192kJ=0.9mol����N2��ת����Ϊ0.9/x����B����
C��x=1��y=3�����ڷ�Ӧ�����������С��N����������ƽ���൱�ں��º����½�����ƽ���С���������ѹǿ����ƽ�������ƶ����ﵽƽ����ת���ʹ�ϵΪ������M��������N������C��ȷ��D��Ҫ��M��N��ƽ��ʱA���������һ������ôֻ����M��N�У���Ӧǰ�����ȶ��٣�A���������ʼ��Ϊ��ֵ���ٶ���Ӧ��AΪzmol����
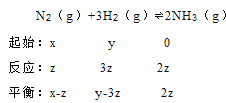
��ƽ��ʱN2�����������xz��/(x+y2Z),N2���������ʼ��Ϊ��ֵ����x=y����x=yʱ��ƽ��ʱN2�����������������������ȣ���D��ȷ����ѡCD��