题目内容
14.将21.8g Na2O与Na2O2的混合物溶于足量水中,称得水溶液净重18.6g,则混合物中Na2O2和Na2O的质量之比为( )| A. | 2:1 | B. | 78:31 | C. | 78:62 | D. | 39:62 |
分析 Na2O2与Na2O的混合物投入足量的水中溶解发生的反应为:①Na2O+H2O═2NaOH、②2Na2O2+2H2O═4NaOH+O2↑,21.8gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重18.6g,减少的3.2g为生成氧气的质量,物质的量为0.1mol,根据反应②知,混合物中过氧化钠的物质的量为0.2mol,质量为15.6g;混合物中氧化钠的质量为21.8g-15.6g=6.2g,由此分析解答.
解答 解:Na2O2与Na2O的混合物投入足量的水中溶解发生的反应为:①Na2O+H2O═2NaOH、②2Na2O2+2H2O═4NaOH+O2↑,21.8gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重18.6g,减少的3.2g为生成氧气的质量,物质的量为0.1mol,根据反应②知,混合物中过氧化钠的物质的量为0.2mol,质量为15.6g;混合物中氧化钠的质量为21.8g-15.6g=6.2g,则原混合物中Na2O2与Na2O的质量之比15.6g:6.2g=78:31,
故选B.
点评 本题考查混合物计算、化学方程式计算,难度中等,注意根据方程式进行解答.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
4.铜锌原电池(如图)工作时,下列叙述正确的是( )
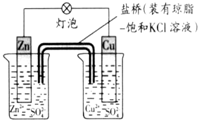

| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
5.用脱脂棉包住约0.2gNa2O2粉末,投入盛满CO2的集气瓶中,棉花燃烧,此实验不能得出的结论是( )
| A. | CO2在一定条件下可以支持燃烧 | B. | 该反应是一个放热反应 | ||
| C. | 该实验的反应中有O2生成 | D. | Na2O2可作为呼吸面具中氧气来源 |
2.下列化合物既能通过单质间的化合反应制得,又能通过单质和稀盐酸反应制得的是( )
| A. | FeCl2 | B. | CuCl2 | C. | AlCl3 | D. | FeCl3 |
4.下列各组中的离子,能在溶液中大量共存的是( )
| A. | NO3-、Ag+、H+、Cl- | B. | CO32-、Na+、Ca2+、NO3- | ||
| C. | Mg2+、Cl-、OH-、CH3COO- | D. | Mg2+、SO42-、K+、Cl- |

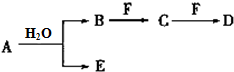 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: ;D中所含化学键的类型离子键、共价键.
;D中所含化学键的类型离子键、共价键.