题目内容
【题目】下列叙述中,不正确的是
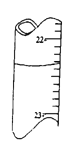
A. 用0.1026mol/L的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为22.35mL
B. 用标准烧碱溶液滴定待测的醋酸溶液,应以酚酞为指示剂
C. 若200mLc(H+)=1×10-3mol/L的某一元酸和100mLc(OH-)=1×10-3mol/L的某一元碱相混合后,溶液呈碱性。则所用的酸和碱可能是等浓度的弱酸和强碱
D. 25℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则a+b=15
【答案】C
【解析】A、滴定管的零刻度在上面,滴定管中的液面读数为22.35mL,故A正确;B、烧碱与醋酸溶液刚好完全反应时,生成的醋酸钠溶液呈碱性,用标准烧碱溶液滴定待测的醋酸溶液,应以酚酞为指示剂,故B正确;C、若为等浓度的弱酸和强碱,一元酸的体积为一元碱的体积的2倍,反应后酸剩余,溶液的pH<7;若为稀的强酸和稀的强碱,一元酸的体积为一元碱的体积的2倍,反应后酸剩余,溶液的pH<7;若为稀的弱酸和浓的强碱,弱酸浓度大于碱的浓度,且一元酸的体积为一元碱的体积的2倍,反应后酸剩余,溶液的pH<7;若为稀的强酸和浓的弱碱,弱碱浓度大,当一元酸的体积为一元碱的体积的2倍时,反应后碱可能剩余,溶液pH>7,应为稀的强酸和浓的弱碱,故C错误;D、常温下,PH=a的强酸溶液中氢离子浓度为10-a mol·L-1,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol·L-1,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以10×10-a=1×10 b-14,10a+b=1015,所以a+b=15,故D正确。故选C。

练习册系列答案
相关题目
