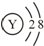题目内容
下列比较,正确的是( )
| A.稳定性H2S>HCl>HBr>HI |
| B.酸性HClO4>H2SO4>CH3COOH>H2CO3 |
| C.粒子半径S2-<Cl-<K+<Ca2+ |
| D.沸点HI>HBr>HCl>HF |
A.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,稳定性HCl>H2S,故A错误;
B.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的酸性越强,则酸性HClO4>H2SO4,醋酸和碳酸都为弱酸,醋酸酸性较强,可与碳酸钠反应生成二氧化碳可证明酸性的强弱,则酸性HClO4>H2SO4>CH3COOH>H2CO3,故B正确;
C.核外电子排布相同的离子,核电荷数越大,离子半径越小,应为Cl-<S2-<Ca2+<K+,故C错误;
D.HF含有氢键,沸点最高,故D错误.
故选B.
B.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的酸性越强,则酸性HClO4>H2SO4,醋酸和碳酸都为弱酸,醋酸酸性较强,可与碳酸钠反应生成二氧化碳可证明酸性的强弱,则酸性HClO4>H2SO4>CH3COOH>H2CO3,故B正确;
C.核外电子排布相同的离子,核电荷数越大,离子半径越小,应为Cl-<S2-<Ca2+<K+,故C错误;
D.HF含有氢键,沸点最高,故D错误.
故选B.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目