题目内容
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一,以下方法可以消除氮氧化物和硫氧化物的污染。
(1)用活性炭还原法可处理氮氧化物,向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() △H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
△H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.52 | 0.40 | 0.40 | 0.44 | 0.44 |
N2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
CO2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
①0~10min内,NO的平均反应速率v(NO)=_______________。
②在恒容条件下,能判断该反应一定达到化学平衡状态的标志是_________(填字母编号)。
a.v正(N2)=2v逆(NO) b.反应体系的压强不再发生改变
c.![]() 不变 d.混合气体的密度保持不变
不变 d.混合气体的密度保持不变
③30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________。
(2)NH3催化还原氮氧化物技术是目前应用最广泛的烟气氮氧化物脱除技术。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为_____________________________________________________。
(3)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____________________。
②吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如下表:
)变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
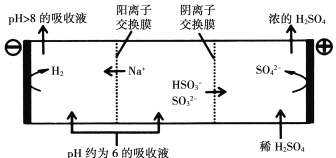
写出![]() 在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,求吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
【答案】0.048mol/(L·min) c d 升高温度 2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g) △H=-2Q kJ/mol 2OH-+SO2=![]() +H2O
+H2O ![]() -2e-+H2O=
-2e-+H2O=![]() +3H+ 2.8×10-7mo1/L
+3H+ 2.8×10-7mo1/L
【解析】
(1)用活性炭还原法可处理氮氧化物,向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() △H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表:
△H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.52 | 0.40 | 0.40 | 0.44 | 0.44 |
N2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
CO2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
①分析图表数据,010min内,NO的平均反应速率v(NO)=![]() =0.048mol/(Lmin);
=0.048mol/(Lmin);
答案为:0.048mol/(Lmin);
②a.不同物质的反应速率之比等于计量系数之比时,可判定反应达到平衡状态,v正(N2):v逆(NO) =1:2,即2 v正(N2)= v逆(NO),故a错误;
b.根据反应:![]() 可知,该体系是反应前后气体体积不变的体系,平衡不受压强影响,反应体系的压强不再发生改变,不能判定达到平衡状态,故b错误;
可知,该体系是反应前后气体体积不变的体系,平衡不受压强影响,反应体系的压强不再发生改变,不能判定达到平衡状态,故b错误;
c.![]() 为平衡常数,平衡常数不变,说明反应体系中各组分的含量不再变化,反应达到平衡状态,故c正确;
为平衡常数,平衡常数不变,说明反应体系中各组分的含量不再变化,反应达到平衡状态,故c正确;
d.该体系为气体平均摩尔质量增大的体系,气体的摩尔质量与混合气体的密度成正比,摩尔质量保持不变,则密度保持不变,反应达到平衡,故d正确;
答案选cd;
③30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮浓度增大,氮气,二氧化碳浓度都减小;说明条件的改变使平衡反应向逆反应方向进行,根据反应![]() △H<0,正反应放热,逆反应吸热,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大;
△H<0,正反应放热,逆反应吸热,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大;
答案为:升高温度;
(2)利用H3催化还原氮氧化物技术可将一氧化氮和二氧化氮转化为氮气,且c(NO2):c(NO)=1:1时脱氮效果最佳,发生的反应为2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g),生成1mol N2时反应放出的热量为Q kJ,则该反应的焓变△H=2QkJ/mol,所以时对应的脱氮反应的热化学方程式为:2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H=2QkJ/mol,
故答案为:2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H=2QkJ/mol;
(3)①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2=![]() +H2O;
+H2O;
答案为:2OH-+SO2=![]() +H2O;
+H2O;
②结合表格数据,当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:![]() -2e-+H2O= SO42-+3H+;
-2e-+H2O= SO42-+3H+;
故答案为:![]() -2e-+H2O=SO42-+3H+;
-2e-+H2O=SO42-+3H+;
(4)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)= 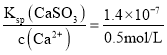 =2.8×10-7mol/L;
=2.8×10-7mol/L;
答案为:2.8×10-7mol/L。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
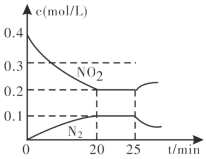
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度