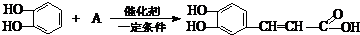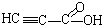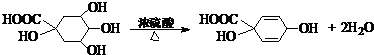题目内容
(2011?奉贤区二模)25时,部分弱酸的电离平衡常数如下表:
|
分析:A.电离平衡常数越大,酸性越强,电离程度越大;
B.等浓度时生成NaCN,CN-离子水解;
C.加水促进电离,离子浓度增大,后来水的体积增大的多,离子浓度减小;
D.根据电荷守恒来分析.
B.等浓度时生成NaCN,CN-离子水解;
C.加水促进电离,离子浓度增大,后来水的体积增大的多,离子浓度减小;
D.根据电荷守恒来分析.
解答:解:A.由表格中的数据可知,醋酸电离平衡常数最大,酸性最强,则酸性越强,盐的水解越弱,所以等物质的量浓度溶液的pH关系为pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B.等浓度时生成NaCN,CN-离子水解,则C(Na+)>c(CN-),所以a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合后,所得溶液中:C(Na+)>c(CN-),则a≤b,故B错误;
C.往冰醋酸中逐滴加水,离子浓度增大,后来水的体积增大的多,离子浓度减小,所以溶液的导电性先增大后减小,故C正确;
D.NaHCO3和Na2CO3的混合液中存在电荷守恒为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
B.等浓度时生成NaCN,CN-离子水解,则C(Na+)>c(CN-),所以a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合后,所得溶液中:C(Na+)>c(CN-),则a≤b,故B错误;
C.往冰醋酸中逐滴加水,离子浓度增大,后来水的体积增大的多,离子浓度减小,所以溶液的导电性先增大后减小,故C正确;
D.NaHCO3和Na2CO3的混合液中存在电荷守恒为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
点评:本题考查电离、水解及溶液中离子浓度的关系,综合性较强,题目难度中等,注意表格中数据的应用来解答.

练习册系列答案
相关题目
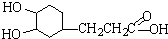 (
( 或
或 )
)