题目内容
下列事实能说明氯的非金属性比硫强的是
| A.次氯酸的酸性比硫酸弱 |
| B.氯气能置换氢硫酸(H2S的水溶液)中的硫 |
| C.氢硫酸是弱酸,而盐酸是强酸 |
| D.硫在常温下为固态,而氯气为气态 |
B
解析试题分析:比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断。A、元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,HClO4酸性比H2SO4强,可说明氯元素的非金属性比硫元素强。但次氯酸不是最高价氧化物对应的水化物,A不正确;B、元素的非金属性越强,对应单质的氧化性越强,氯气与H2S能发生置换反应生成单质S和氯化氢,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故B正确;C、不能根据氢化物的水溶液的酸性强弱比较非金属性,例如HF的酸性比HCl弱,但非金属性F>Cl,氢硫酸的酸性比盐酸弱,但非金属性Cl>S,故C错误;D、元素的非金属性强弱与其单质在常温下的状态无关系,故D不正确,答案选B。
考点:考查元素非金属性强弱的判断

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
| A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D.Z的氢化物比X的氢化物更稳定 |
下列有关原子结构或元素性质说法正确的是
| A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B.基态碳原子的价电子排布图: |
C.基态铜原子的价电子排布图: |
| D.Fe3+的最外层电子排布式为:3s23p63d5 |
下列分子中所有原子都满足最外层为8个电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是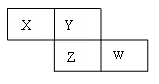
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
下列说法正确的是
| A.第ⅦA族元素的非金属性比第ⅥA族元素的强 |
| B.第三周期元素的简单阳离子半径从左到右逐渐减小 |
| C.第ⅤA族元素非金属氧化物对应的水化物的酸性从上到下依次减弱 |
| D.依据元素周期表、周期律推测尚未发现的第七周期第ⅦA族元素应为非金属元素 |
下列元素中非金属性最强的是
| A.氯 | B.氧 | C.氟 | D.溴 |