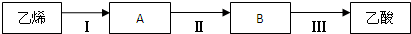题目内容
下列物质的熔点高低顺序,正确的是( )
| A、金刚石>晶体硅>碳化硅 |
| B、K>Na>Li |
| C、NaF<NaCl<NaBr |
| D、CI4>CBr4>CCl4>CH4 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系
专题:化学键与晶体结构
分析:A.原子晶体的组成元素的原子半径越小,键能越大,熔沸点越高;
B.碱金属元素从上到下熔沸点逐渐降低;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
D.分子晶体中相对分子质量越大,熔点越大.
B.碱金属元素从上到下熔沸点逐渐降低;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
D.分子晶体中相对分子质量越大,熔点越大.
解答:
解:A.键长:C-C<C-Si<Si-Si,则熔点:金刚石>碳化硅>晶体硅,故A错误;
B.碱金属元素从上到下熔沸点逐渐降低,则熔点:K<Na<Li,故B错误;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,则熔点:NaF>NaCl>NaBr,故C错误;
D.因分子晶体中相对分子质量越大,熔点越大,则熔点:CI4>CBr4>CCl4>CH4,故D正确;
故选D.
B.碱金属元素从上到下熔沸点逐渐降低,则熔点:K<Na<Li,故B错误;
C.结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高,则熔点:NaF>NaCl>NaBr,故C错误;
D.因分子晶体中相对分子质量越大,熔点越大,则熔点:CI4>CBr4>CCl4>CH4,故D正确;
故选D.
点评:本题考查晶体的熔沸点的比较,题目难度中等,本题注意判断晶体的类型以及影响晶体熔沸点高低的因素,学习中注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定温度下,体积固定的密闭容器中进行可逆反应A(g)+3B(g)?2C(g),下列关于该反应达到平衡状态的标志的说法中不正确的是( )
| A、单位时间内生成n mol A,同时生成3n mol B |
| B、A、B、C的浓度不再发生变化 |
| C、混合气体的压强不再发生改变 |
| D、C生成的速率与C分解的速率相等 |
下列关于乙烯和苯的叙述中,错误的是( )
| A、乙烯能使酸性高锰酸钾溶液褪色 |
| B、两者都可以燃烧 |
| C、苯能使酸性高锰酸钾溶液褪色 |
| D、两者所有原子都在同一平面上 |
现代家庭装修是居室污染的重要来源,关于下列物质中不是居室污染物的是( )
| A、二氧化碳 |
| B、氨气 |
| C、三苯(苯、甲苯、二甲苯) |
| D、甲醛 |
下列说法中正确的是( )
| A、单质硅是将太阳能转化为电能的常用材料 |
| B、能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C、原子的最外电子层只有1个电子的元素一定是金属元素 |
| D、光束通过稀豆浆,不会产生丁达尔效应 |
下列反应中,能量变化不符合如图图示的是( )
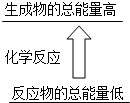

| A、酸与碱的中和反应 |
| B、煅烧石灰石制生石灰 |
| C、Ba(OH)2?8H2O与NH4Cl晶体反应 |
| D、焦炭与水蒸气反应 |
下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
A、CH3CH=CH2和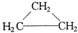 |
| B、乙炔和苯 |
C、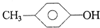 和 和 |
| D、葡萄糖与麦芽糖 |
化学实验应与化工生产一样遵循绿色化学的原则,实现原料和过程绿色化.下列操作符合绿色化学原则的是( )
| A、为便于观察铜在氯气中燃烧的现象,加大氯气的使用量 | ||||
| B、实验室改用H2O2和MnO2反应,代替加热KClO3和MnO2制取氧气 | ||||
| C、焚烧塑料、橡胶等废弃物是处理城市生产、生活垃圾的有效方法 | ||||
D、制取CuSO4:Cu+2H2SO4(浓)
|