题目内容
【题目】常温下,向0.10molL﹣1的醋酸溶液中逐滴滴入0.10molL﹣1的氢氧化钠溶液,溶液的pH变化如下图所示,下列有关叙述正确的是( )
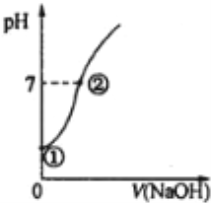
A. ①点所示溶液中只存在醋酸的电离平衡
B. 水的电离程度:①>②
C. 在②点加入氢氧化钠溶液的体积与醋酸的体积相同
D. ②点所示溶液中:c(Na+)+ c(H+)=c(OH﹣)+c(CH3COO﹣)
【答案】D
【解析】A、①点时没有加入氢氧化钠,溶液中存在醋酸和水的电离平衡,选项A错误;①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,即:①<②,选项B错误;恰好中和时,酸碱的体积相同,生成醋酸钠水解,溶液显碱性,②点时溶液成中性,碱的体积少,选项C错误;②点时溶液pH=7,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(Na+)= c(CH3COO﹣)+c(OH﹣),选项D正确。答案选D。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
【题目】合金与铁的物理性质的比较如下表所示:
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该合金耐腐蚀,强度大.从以上性能看,该合金不适合用作( )
A.导线
B.门窗框
C.炉具
D.飞机外壳