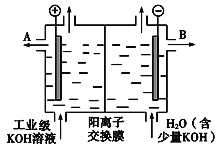
��Ŀ����
����Ŀ��H2RO3��һ�ֶ�Ԫ�ᣬ�����£���1L 1 mol��L-1 Na2RO3��Һ����RO2���壬��Һ��pH��RO2��������ʵ����仯��ͼ��ʾ������˵������ȷ����
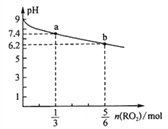
A. a����Һ��2c(Na+)<3c(RO32-)
B. �����£�NaHRO3��Һ��c(HRO3-)>c(RO32-)>c(H2RO3)
C. ��b����Һ�м�ˮ��ʹ��Һ��pH��6.2���ߵ�8.0
D. ������RO2����Һ������ʱc(Na+)=2c(RO32-)+2c(HRO3-)
���𰸡�B
��������A����Һ�к�H2RO3 1mol��Na2RO3+H2O+RO2=2NaHRO3������a��ͨ��1/3molRO2����Һ������2/3molNaHRO3��ʣ��Na2RO32/3mol�����ߵ�������Na+2mol��RO32-2/3mol����ʱa����Һ�ʼ��ԣ�˵��RO32-���ӷ���ˮ�⣬��c(Na+)>3c(RO32-)��2c(Na+)>3c(RO32-)��A����B����ͨ��5/6molRO2ʱ����Һ������5/3molNaHRO3��ʣ��Na2RO31/6mol����ʱ��ҺpH=6.2�����ԣ�˵����Һ����HRO3-�Ե���Ϊ����HRO3-ˮ�����ɵ�H2RO3����Ũ��С�ڵ������ɵ�RO32-����Ũ�ȣ�ͬʱ����ҺpHֵ�ӽ�7�����жϵ����HRO3-������Ȼֻ��һС���֣�����NaHRO3��Һ��c(HRO3-)>c(RO32-)>c(H2RO3)��B��ȷ��C��b�����ڵ�����Һ����Ե���Ҫ����ΪHRO3�ĵ��룬�����Һ��ˮ�����ɵ�H+Ũ����С��pH����������pHֻ�����ӽ�7�������Ϊ8.0��C���� D��������RO2����Һ������ʱ�����ݵ���غ㣬c(H+)+c(Na+)=2c(RO32-)+c(HRO3-)+c(OH-)��������Һ��c(H+)=c(OH-)������c(Na+)=2c(RO32-)+c(HRO3-)��D������ȷ��B��