题目内容
9.已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③[1]K2Cr2O7+[6]FeSO4+[7]H2SO4=[3]Fe2(SO4)3+[1]Cr2(SO4)3+[1]K2SO4+[7]H2O
(1)上述三个反应中,属于氧化还原反应的是②③(填序号);
(2)配平反应③的化学方程式;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:K2Cr2O7>Fe3+>I2.
分析 (1)氧化还原反应的判断依据:有化合价变化;
(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
(3)依据氧化还原反应中氧化剂氧化性大于氧化产物氧化性判断解答.
解答 解:(1)①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,反应中各元素化合价都不变,不是氧化还原反应;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4,反应中铁元素化合价降低,碘元素化合价升高,属于氧化还原反应;
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,反应中Cr元素化合价降低,二价铁离子化合价升高,属于氧化还原反应;
故答案为:②③;
(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,要使氧化剂得到电子总数等于还原剂失去电子总数,则K2Cr2O7系数为1,FeSO4系数为6,依据原子个数守恒,反应方程式:K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
故答案为:1;6;7H2SO4;3;1;1;7;
(3)Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中三价铁为氧化剂,碘单质为氧化产物,所以氧化性:Fe3+>I2;
K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,K2Cr2O7为氧化剂,Fe3+为氧化产物,所以氧化性:K2Cr2O7>Fe3+>I2;
所以K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:K2Cr2O7>Fe3+>I2;
故答案为:K2Cr2O7>Fe3+>I2.
点评 本题考查了氧化还原反应,设计氧化还原反应的判断、方程式的配平、氧化性强弱的判断,熟悉氧化还原反应规律是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
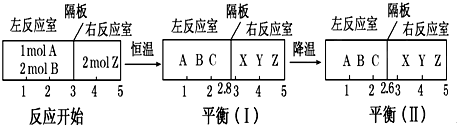
小学生10分钟应用题系列答案| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
| A. | 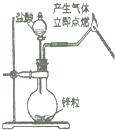 验证氢气的可燃性 | B. |  闻气体气味 | ||
| C. |  移走蒸发皿 | D. | 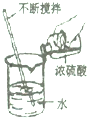 稀释浓硫酸 |
| A. | 室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小 | |
| B. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 | |
| C. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| D. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
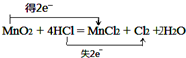 .
.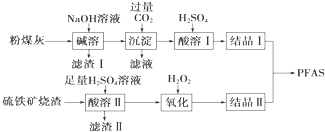 聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图: