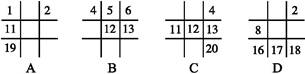
题目内容
有X,Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,则X,Y元素的元素符号分别为
| A.Mg和S | B.N和Be | C.Si和B | D.C和Al |
D
解析试题分析:X原子的M电子层比Y原子的M电子层少3个电子,说明Y原子的核外电子数比X多;Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,Y原子的L层电子数应是8,则X的L层电子数是4未排满,M层电子数是0,则Y原子的M层电子数是3,所以X是C元素,Y是Al元素,4选D。
考点:考查原子的核外电子排布规律及元素推断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是( )
| A.N5+ 离子中含有36个电子 | B.H2与H3属于同素异形体 |
| C.C60的摩尔质量为720 | D.O2与O4属于同位素 |
下列物质性质的递变关系正确的是
| A.原子半径:C>Al>Na>K | B.碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 |
| C.离子半径:O2->F->Al3+>Mg2+>Na+ | D.最高价:Cl>Si>Al>F |
X2-的核外电子排布为2、8、8,则X元素在周期表中的位置是
| A.第三周期0族 | B.第三周期VIA族 |
| C.第三周期VIIA族 | D.第四周期IA族 |
根据元素在周期表中的位置判断,下列元素中原子半径最小的是
| A.氧 | B.氟 | C.碳 | D.氮 |
下列关于原子结构、元素性质的说法正确的是( )。
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素。已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水。下列推测中,不正确的是( )。
| A.Sr(OH)2溶解于水 | B.SrSO4易溶于水 |
| C.BaSO4不溶于水 | D.Ba(OH)2比Ca(OH)2更易溶于水 |