题目内容
9.下列说法正确的是( )①检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水
②除去乙醇中微量水可加入金属钠,使其完全反应
③获得无水乙醇的方法是直接加热蒸馏
④收集乙酸乙酯的方法是将产生的气体通入饱和碳酸钠溶液中.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
分析 ①无水硫酸铜遇水变蓝;
②乙醇、水均与Na反应;
③直接蒸馏易发生共沸,难得到无水乙醇;
④饱和碳酸钠吸收乙酸、乙醇,降低乙酸乙酯的溶解度.
解答 解:①无水硫酸铜遇水变蓝,则加入少量的无水硫酸铜,如变蓝则含水,故正确;
②乙醇、水均与Na反应,不能除杂,应加CaO、蒸馏除杂,故错误;
③直接蒸馏易发生共沸,难得到无水乙醇,应加CaO、蒸馏得到无水乙醇,故错误;
④饱和碳酸钠吸收乙酸、乙醇,降低乙酸乙酯的溶解度,则通入饱和碳酸钠溶液、分液可得到乙酸乙酯,故正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质检验、混合物分离提纯等,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列实验操作正确的是( )
| 选项 | 实验 | 操作 |
| A | 验证Cl2和Br2的非金属性强弱 | 将少量氯水加入盛有FeBr2溶液的试管中,用力振荡后加入少量乙醇,振荡,静置 |
| B | 检验溶液中是否含有SO42- | 用HNO3溶液酸化后再加BaCl2溶液 |
| C | 证明浓硫酸有脱水性和强氧化性 | 将浓硫酸滴到蔗糖表面 |
| D | 制取Fe(OH)3胶体 | 将烧碱溶液滴加到FeCl2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
17.下列实验中,仪器的下端必须插入液面以下的是( )
①制备氢气的简易装置中加入稀硫酸的长颈漏斗
②制备氯气装置中的分液漏斗
③用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2操作中的胶头滴管
④将氯气溶于水时制取氯水的导气管
⑤蒸馏石油时的温度计.
①制备氢气的简易装置中加入稀硫酸的长颈漏斗
②制备氯气装置中的分液漏斗
③用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2操作中的胶头滴管
④将氯气溶于水时制取氯水的导气管
⑤蒸馏石油时的温度计.
| A. | ①③ | B. | ②④⑤ | C. | ①③④ | D. | 全部 |
4.下列指定反应的离子方程式正确的是( )
| A. | 向漂白粉溶液中通入过量的SO2气体:ClO-+SO2+H2O═HSO3-+HClO | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Fe(NO3) 3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L三氧化硫所含有的原子数目为2NA | |
| B. | 分解H2O2制O2,每生成1mol O2转移2NA个电子 | |
| C. | 62 g Na2O溶于水后所得溶液中含有O2-数为NA | |
| D. | 36.5 g HCl中含有Cl-数为NA |
19.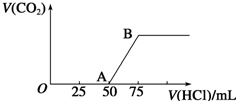 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056L | |
| D. | 原NaOH溶液的物质的量浓度为0.5mol•L-1 |

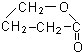 +2H2O.
+2H2O.