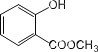
题目内容
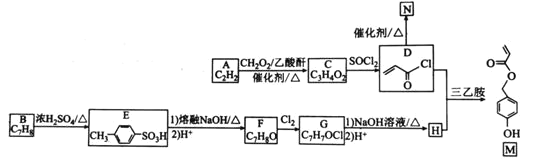
【题目】向 Na2CO3 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).
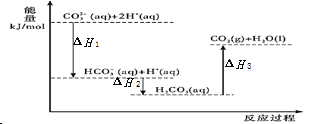
A.△H1 >△H2 ; △H2<△H3
B.反应 ![]() (aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
(aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
C.![]() (aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3 变小
【答案】C
【解析】
A.由图象可知,能量差值越大,反应热的绝对值越大,△H1、△H2都为放热反应,值为负值,则△H1<△H2,故A错误;
B.由图象可知反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 中反应物能量低,生成物能量高,为吸热反应,故B错误;
C.由盖斯定律可知CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3),故C正确;
D.H2CO3(aq)=CO2(g)+H2O(l),加入催化剂,反应热不变,故D错误;
答案为C。

练习册系列答案
相关题目
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大