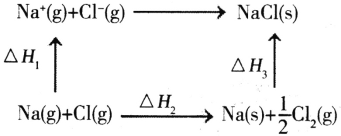
题目内容
【题目】已知:在25 oC 101KPa时
①1g氢气完全燃烧生成气态水放出120.9 KJ的热量
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
③Na2O2(s)+CO2(g)=Na2CO3(s)+![]() ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
在相同条件下根据以上信息回答下列问题:
(1)请书写氢气完全燃烧生成气态水的热化学方程式_______________________________。
(2)CO的燃烧热为ΔH=_____。
(3)请写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式_______________________。
(4)请计算CO(g)与Na2O2(s)反应放出1018kJ热量时,转移电子的物质的量__________________。
【答案】2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol- -283 kJ/mol Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol 4 mol
【解析】
(1)根据“1g氢气完全燃烧生成气态水放出120.9KJ的热量”计算出2mol氢气完全燃烧放出的热量,根据热化学方程式的书写方法写出热化学方程式;
(2)燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,据此计算出一氧化碳的燃烧热;
(3)根据盖斯定律及题中热化学方程式写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式;
(4)根据放出的热量计算出消耗一氧化碳的物质的量,然后根据化合价变化计算出转移的电子数。
(1)1g氢气完全燃烧生成气态水放出120.9kJ的热量,4g氢气完全燃烧生成气态水放出的热量为:483.6kJ,氢气完全燃烧生成气态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol-1,故答案为:2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol-1;
(2)1 molCO完全燃烧生成稳定氧化物二氧化碳时所放出的热量为:![]() ×566kJ=283kJ,△H= -283kJ/mol,故答案为:-283kJ/mol;
×566kJ=283kJ,△H= -283kJ/mol,故答案为:-283kJ/mol;
(3)②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;③Na2O2(s)+CO2(g)=Na2CO3(s)+![]() ΔH=-226 kJ/mol;根据盖斯定律,③+②÷2可得:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol,故答案为:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol;
ΔH=-226 kJ/mol;根据盖斯定律,③+②÷2可得:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol,故答案为:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol;
(4)CO(g)与Na2O2(s)反应放出1018kJ热量,消耗一氧化碳的物质的量为:![]() =2mol,CO转化成二氧化碳,化合价升高2价,所以反应消耗2mol一氧化碳失去了2mol×2=4mol电子,故答案为:4mol。
=2mol,CO转化成二氧化碳,化合价升高2价,所以反应消耗2mol一氧化碳失去了2mol×2=4mol电子,故答案为:4mol。

 智慧小复习系列答案
智慧小复习系列答案