题目内容
【题目】已知反应:![]()
![]()
![]() 某温度下,在4L密闭容器中加入纳米级
某温度下,在4L密闭容器中加入纳米级![]() 并通入
并通入![]()
![]() ,记录不同时间产生
,记录不同时间产生![]() 的物质的量如表:
的物质的量如表:
时间 | 20 | 40 | 60 | 80 |
|
|
|
|
|
下列说法正确的是
A.前20min的反应速率![]()
B.达平衡时,至少需要从外界吸收的能量为![]()
C.增大![]() ,可以提高水的分解率
,可以提高水的分解率
D.使用纳米级![]() 颗粒是为了提高催化效果
颗粒是为了提高催化效果
【答案】D
【解析】
![]() 前20min内生成
前20min内生成![]() ,则消耗水
,则消耗水![]() ,
, ,故A错误;
,故A错误;
B.达到平衡时,生成![]() ,则需要从外界吸收的能量为
,则需要从外界吸收的能量为![]() kJ,故B错误;
kJ,故B错误;
C.增大![]() ,虽然平衡向正反应分向移动,因为体积的压强也增大,增大压强不利于正反应的发生,故平衡移动的程度小于增加的水的量,水的分解率反而降低,故C错误;
,虽然平衡向正反应分向移动,因为体积的压强也增大,增大压强不利于正反应的发生,故平衡移动的程度小于增加的水的量,水的分解率反而降低,故C错误;
D. 纳米级![]() 颗粒的比表面积非常大,催化剂表面积越大,则反应物在其表面的接触面积越大,反应反应速率越大,故D正确。
颗粒的比表面积非常大,催化剂表面积越大,则反应物在其表面的接触面积越大,反应反应速率越大,故D正确。
故选:D。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
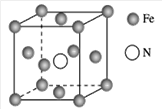
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。