题目内容
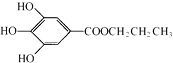
【题目】如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C,D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2N2O4△H=﹣57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时: 
(1)C中的气体颜色;D中的气体颜色 .
(2)25℃时,2NO2N2O4达到平衡时,c(NO2)=0.012 5mol/L,c(N2O4)=0.032 1mol/L,则NO2的起始浓度为 , NO2的转化率为 .
【答案】
(1)变浅;变深
(2)0.0767mol/L;83.7%
【解析】解:(1)A中硝酸铵的溶解过程是吸热过程,溶解后C中温度降低,化学平衡2NO2N2O4 , △H=﹣57kJ/mol,会向着正反应方向进行,所以颜色变浅,D中氢氧化钠溶于是放热、与盐酸反应放出热量,温度升高,平衡向逆反应方向移动,二氧化氮的浓度增大,颜色变深,
所以答案是:变浅;变深;(2)设:二氧化氮的初始浓度为cmol/L,根据题意信息可知:
2NO2 N2O4
初始浓度(mol/L):c 0
变化浓度(mol/L):c﹣0.0125 0.0321
平衡时浓度(mol/L):0.0125 0.0321
则c﹣0.0125=2×0.0321,解得c=0.0767mol/L,
NO2的转化率为 ![]() ×100%≈83.7%.
×100%≈83.7%.
所以答案是:0.0767mol/L;83.7%.
【考点精析】利用化学平衡状态本质及特征和化学平衡的计算对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.