题目内容
【题目】下列物质的用途错误的是( )
A.明矾:净水剂B.过氧化钠:供氧剂和漂白剂
C.碳酸氢钠:胃酸中和剂D.生石灰:食品抗氧化剂
【答案】D
【解析】
A. 明矾的主要成分是KAl(SO4)212H2O,是常用的净水剂,A项正确,不符合题意;
B. 过氧化钠与水或CO2反应均能生成氧气,且具有较强的氧化性,因此是供氧剂和漂白剂,B项正确,不符合题意;
C. 碳酸氢钠与胃酸反应生成氯化钠、水和CO2,是常用的胃酸中和剂,C项正确,不符合题意;
D. 生石灰的主要成分是CaO,与水反应生成Ca(OH)2,是常用的干燥剂,氧化钙不具有还原性,不能用作抗氧化剂,D项错误,符合题意;
答案选D。

【题目】有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(1)该混合溶液中Ba(OH)2的物质的量浓度=_____________。
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=___________。
【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
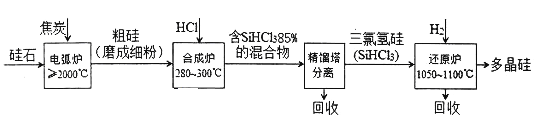
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
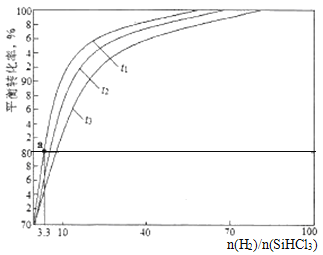
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。