题目内容
(2013?芜湖模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.有关说法不正确的是( )
分析:该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.
解答:解:A.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故A正确;
B.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
C.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故C错误;
D.消耗0.5 mol二甲醚可以向外电路提供电子的物质的量=0.5mol×2×(4+2)=6mol,故D正确;
故选C.
B.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
C.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故C错误;
D.消耗0.5 mol二甲醚可以向外电路提供电子的物质的量=0.5mol×2×(4+2)=6mol,故D正确;
故选C.
点评:本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
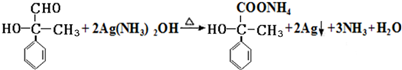
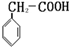 或
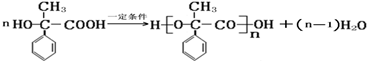
或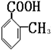 或
或 或
或