题目内容
已知某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属没有剩余,反应中转移的电子数目为2y NA |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80 y(1-a/3) |
| D.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 |
C
解析试题分析:A、Fe可能被氧化为Fe3+,也可能被氧化为Fe2+,所以反应中转移的电子数目不一定为2y NA,错误;B、当金属全部溶解时,Fe可能以Fe2+的形式存在,不一定 Fe3+,错误;C、HNO3和金属反应,参加反应的HNO3一部分作氧化剂生成NO,另一部分体现酸性生成硝酸盐,则:n(Cu)=aymol,n(Fe)="(1-a)y" mol ,作酸性的HNO3为2n[Cu(NO3)2]+3n[Fe(NO3)3]="2aymol+3(1-a)y" mol=(3-ay)mol;由电子守恒可得:生成的NO的物质的量,即被还原的硝酸的量n(NO)=[2aymol+(3-ay)mol]/3=(3-ay)/3mol,所以参加反应的硝 酸 n(HNO3)=(4-4ay/3)mol,则bX0.05≥(4-4ay/3)mol,得b≥80y(1-a/3),正确;D、当b=0.3时,参加反应的HNO3最多为0.05LX0.3mol?L?1 =0.015mol,n(NO)="(336/22.4)X1000=0.015" mo,因为参加反应的HNO3物质的量应该大于0.015mol,而这里n(HNO3)=0.015mol,显然不成立,错误。
考点:本题考查根据电子转移和化学方程式的计算。

下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50mL 1mol/L NaCl溶液 | D.25mL 0.5mol/L HCl溶液 |
设NA为阿伏加德罗常数,下列说法正确的是:
| A.1mol铁与1molCl2充分反应,转移电子数为3NA |
| B.常温常压下,22.4L NH3所含的分子数为NA |
| C.常温下,44g CO2中含有2NA个C=O键 |
| D.1mol/L的A1C13溶液中,Al3+离子的数目略小于NA |
设NA为阿伏伽德罗常数的数值,则下列说法中不正确的是
①2.24L氖气含有NA个电子,② 18g中所含的中子数为10NA,③标准状况下,11.2LSO3含有的分子数为0.5NA,④ 过氧化钠与水反应,若电子转移2NA,则产生的氧气为32 g,⑤在1L 0.1mol/L的碳酸钠溶液中,氧原子总数为0.3NA
| A.①②③⑤ | B.①④⑤ | C.①②③ | D.②③⑤ |
食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的结构示意图为: |
| B.蔗糖和醋酸都是弱电解质 |
C.“84消毒液”中有效成分NaClO的电子式为: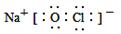 |
| D.明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B.1.0L 0.1mol?L-1Na2CO3溶液中含有的CO32—离子数目为0.1NA |
| C.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NA |
| D.在标准状况下,2.24L的CH3CH2OH含有NA个分子 |
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
| A.18 g H2O中含有的质子数为10NA |
| B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA |
下列条件下,两瓶气体所含原子数一定相等的是( )
| A.同质量的C2H4和CO | B.同体积、同密度的C2 H4和C3 H6 |
| C.同温度、同体积的H2和N2 | D.同压强、同体积的N2 O和CO2 |
同温同压下有两份体积相同的CO2和O3,关于它们的叙述正确的是( )
| A.分子数之比是1:1 | B.原子个数比是3:2 |
| C.质子数比是 12:11 | D.密度之比是1:1 |