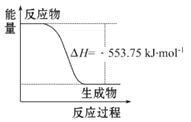
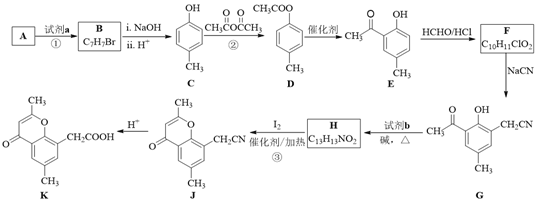
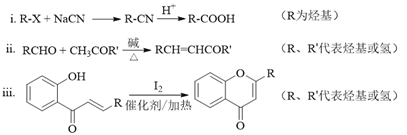题目内容
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
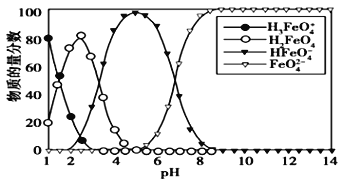
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
【答案】C
【解析】A.图示可以看出其中含有HFeO4-,向pH=5的高铁酸盐溶液中加入KOH溶液生成FeO42-,则HFeO4-和KOH溶液之碱反应,即HFeO4-+OH-=FeO42-+H2O,故A正确;B.pH≥9时,FeO42-含量接近100%,则为获得尽可能纯净的高铁酸盐,pH应控制pH≥9,故B正确;C.根据H3FeO4+ 的电离常数分析,其电离平衡常数K2=c(HFeO4 -)c(H +)/c(H2FeO4)=4.8×10-4,则当溶液中pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=4.8×10 -4/10 -4=4.8,故C错误;D.由图象纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>C(HFeO4-),故D正确。故选:C。

 阅读快车系列答案
阅读快车系列答案【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:
①在酸性环境下,Cr(VI)通常以Cr2O72-的形式存在,Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
②Cr2O72-的氧化能力强于CrO42-
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI)。下列关于焦炭的说法正确的是________(填字母序号)。
a. 作原电池的正极 b. 在反应中作还原剂 c. 表面可能有气泡产生

II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如右图所示。
(2)A极连接电源的________极,A极上的电极反应式是________。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-=H2↑,此外还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为________。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如右图所示。

①由图知,电解还原法应采取的最佳pH范围为________。
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
②解释曲线I和曲线IV去除率低的原因:________。
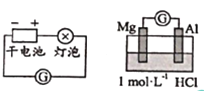
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
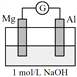
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
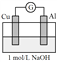
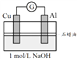
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。