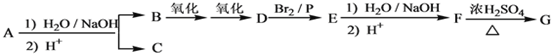题目内容
【题目】(1)已知反应2H2 + O2 ![]() 2H2O为放热反应,破坏1mol的化学键消耗的能量称为化学键的键能。有关物质中化学键的键能如下表,则生成1mol水可以放出热量 __________kJ
2H2O为放热反应,破坏1mol的化学键消耗的能量称为化学键的键能。有关物质中化学键的键能如下表,则生成1mol水可以放出热量 __________kJ
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示,A、B两个电极均由多孔的碳块组成。

①B作_____极材料(填“正”或“负”),电解质溶液中SO42- 移向_____极(填“A”或“B”)。
②写出A极的电极反应式_______,一段时间后,溶液的PH______(填“升高”“降低”“不变”),
③如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,当有标准状况下11.2L CH4完全反应时,导线中通过的电子的数目__________。
【答案】 242 正 A H2-2e-=2H+ 升高 4NA
【解析】(1)考查键能与热量的关系,断裂2molH-H键吸收热量是2×436kJ=872kJ,断裂1molO=O键吸收热量为496kJ,共吸收热量为1368kJ,生成4molH-O键,放出热量为4×463kJ=1852kJ,因此净放出热量为(1852-1368)kJ=484kJ,即生成1molH2O放出的热量为484/2kJ=242kJ;(2)考查原电池的工作原理和电极反应式的书写,①通氧气一极为正极,即B为正极,A为负极,根据原电池的工作原理,阴离子向负极移动,即SO42-向A极移动;②电解质为硫酸,A极反应式为H2-2e-=2H+,正极反应式为O2+4H++4e-=2H2O,电池总反应是2H2+O2=2H2O,对硫酸起到稀释作用,c(H+)降低,因此溶液的pH升高;③CH4转化成CO2,因此转移电子物质的量为11.2×8/22.4mol=4mol,即转移电子数为:4NA。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案