题目内容
设NA为阿伏加德罗常数,下列叙述正确的是
| A.18g水中所含的电子数为8NA |
| B.11.2L氯气所含的分子数为0.5NA |
| C.2.4gMg与足量的盐酸反应失去的电子数为0.2NA |
| D.32g氧气中所含的氧原子数为NA |
C
解析试题分析:A、18gH2O的物质的量为1mol,其含有的电子数为10NA,故A错误;B、在标况下,11.2L氯气的物质的量为0.5mol,其含有的分子数为0.5 NA,而题中没有说明是咋标况下,故B错误;C、2.4gMg的物质的量为0.1mol,其与足量的盐酸反应生成Mg2+失去的电子数0.2 NA,故C正确;D、32g氧气的物质的量为1mol,所含的氧原子数为2NA,故D错误。
考点:阿伏加德罗常数

练习册系列答案
相关题目
NH3和Cl2可快速反应:2NH3+3Cl2 →N2+6HCl 。有100LNH3和Cl2混合气体,充分反应后的混合气体中N2占混合气体的1/7,则N2的物质的量为(标准状况下数据)
| A.0.263 mol | B.0.483 mol | C.0.663 mol | D.0.893 mol |
以下因素中,不会影响气体体积大小的是
| A.分子个数 | B.原子半径 | C.温度 | D.压强 |
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度相同的是
| A.100 mL 0.5 mol/L MgCl2溶液 | B.200 mL 0.25 mol/L AlCl3溶液 |
| C.50 ml 1 mol/L NaCl溶液 | D.25 ml 0.5 mol/L HCl溶液 |
用NA表示阿伏伽德罗常数,下列叙述正确的是
| A.1mol碳正离子( CH5+ )所含的质子数为11NA |
| B.15g乙烷分子中所含非极性共价键数为3NA |
| C.标准状况下,22.4L苯完全燃烧所消耗的氧气分子数为7.5NA |
| D.1L 0.1mol/L乙酸溶液中H+数为0.1NA |
将钾与氧形成的化合物或混合物1.02 g溶于水后,可被0.25 mol/L 盐酸 80 mL恰好中和,则该物质的成分可能是
| A.K2O | B.K2O 和K2O2 | C.K2O2 | D.K2O2和KO2 |
下列有关表述正确的是
(1)—OH与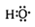 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)HCN分子的结构式:H-C≡N
(3)Br-的离子结构示意图: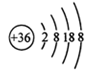
(4)CO2分子的分子模型示意图:
(5)丙烷分子的球棍模型: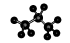
(6)次氯酸的电子式为: 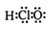
(7)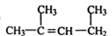 的名称为:1,3-二甲基-2-丁烯
的名称为:1,3-二甲基-2-丁烯
熔化时的电离方程式:NaHSO4为:NaHSO4 Na++HSO4-
Na++HSO4-
| A.(1)(2)(4)(6) | B.(1)(2)(5)(8) |
| C.(1)(4)(5)(8) | D.(2)(3)(5)(7) |
下列对摩尔(mol)的有关说法中错误的是
| A.摩尔是一个单位而非物理量 |
| B.摩尔既能用来计量纯净物,又能用来计量混合物 |
| C.1mol任何气体所含气体的分子数目都相等 |
| D.0.5mol氦约含有1.204×1024个电子 |
设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |