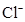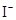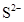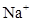题目内容
NH3和Cl2可快速反应:2NH3+3Cl2 →N2+6HCl 。有100LNH3和Cl2混合气体,充分反应后的混合气体中N2占混合气体的1/7,则N2的物质的量为(标准状况下数据)
| A.0.263 mol | B.0.483 mol | C.0.663 mol | D.0.893 mol |
AD
解析试题分析:若按2NH3+3Cl2 →N2+6HCl 反应,生成混合气体中氮气刚好占了1/7,则生成氯化氢的体积为600/5=120L,氮气的体积为20L,物质的量为0.893mol。若氨气过量则有NH3+3Cl2→N2+6HCl,氨过量,所以还会生成氯化铵8NH3+3Cl2→N2 +6NH4Cl;剩余混合气体中氮气和氨气,设氯气体积为x,则氨气为100-x,剩余氨气为100-x-8x/3=100-11x/3,生成氮气的体积为x/3,根据(100-11x/3):x/3=6:1,解得x=17.64L,氮气的物质的量为0.263mol。答案选AD。
考点:本题考查了氯气性质的分析判断,计算式的分析判断未知量的含义,题目难度较大。

练习册系列答案
相关题目
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 |
B.氟原子的结构示意图: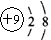 |
C.甲烷的电子式: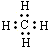 |
| D.碳酸钠的电离方程式:Na2CO3=Na++CO32- |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A.1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA |
| B.0℃、1个标准大气压下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
| C.含4mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| D.将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24 L SO3所含分子数目为0.1NA |
| B.6.0gSiO2中含氧分子的数目为0.1NA |
| C.78g Na2O2固体中含Na+离子的数目为NA |
| D.2.3gNa完全燃烧后失去电子的数目为0.1NA |
下列有关化学用语表示正确的是
A.钾原子结构示意图: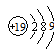 |
B.间羟基苯甲酸的结构简式: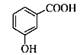 |
C.CO2的比例模型: |
D.Na2S的电子式: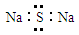 |
下列有关化学用语的说法中不正确的是( )
A.-OH与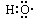 都表示羟基 都表示羟基 |
| B.次氯酸的结构式为:H—Cl—O |
C.CH4分子的球棍模型: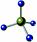 |
D.苯分子的比例模型: |
设NA为阿伏加德罗常数,下列叙述正确的是
| A.18g水中所含的电子数为8NA |
| B.11.2L氯气所含的分子数为0.5NA |
| C.2.4gMg与足量的盐酸反应失去的电子数为0.2NA |
| D.32g氧气中所含的氧原子数为NA |
一定体积的溶质质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大1倍,溶液体积变为62.5 mL。则浓缩后溶液的物质的量浓度为( )。
| A.2.2 mol·L-1 | B.4 mol·L-1 | C.5 mol·L-1 | D.6.25 mol·L-1 |
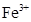 、
、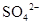 、
、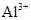 和M离子,且
和M离子,且