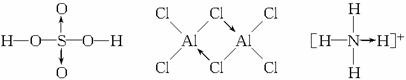
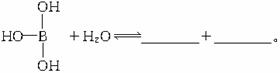
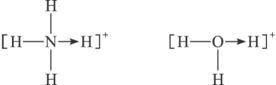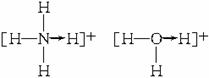题目内容
在水溶液中下列电离方程式书写正确的是( )
分析:物质在水溶液中的电离方程式书写原则是能溶于水的强电解质完全电离,用=,能溶于水的弱电解质存在电离平衡用?,难溶的强电解质物质在水溶液中能溶解的全部电离.
解答:解:A、硫酸是强电解质,是强酸完全电离,H2SO4=2H++SO42-,故A正确;
B、碳酸氢根离子是弱酸阴离子,不能拆成离子,正确的是:NaHCO3=Na++HCO3-,故B错误;
C、氯酸根是算根离子,原子间通过共价键形成,不能拆成离子,正确的是:KClO3=K++ClO3-,故C错误;
D、氯化铜是2个氯离子和一个铜离子构成,正确的是:CuCl2=Cu2++2Cl-,故D错误;
故选A.
B、碳酸氢根离子是弱酸阴离子,不能拆成离子,正确的是:NaHCO3=Na++HCO3-,故B错误;
C、氯酸根是算根离子,原子间通过共价键形成,不能拆成离子,正确的是:KClO3=K++ClO3-,故C错误;
D、氯化铜是2个氯离子和一个铜离子构成,正确的是:CuCl2=Cu2++2Cl-,故D错误;
故选A.
点评:本题考查了的离方程式的书写方法和注意问题,主要是电解质强弱判断,物质溶解性的分析算根离子的电离特征,题目较简单.

练习册系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: