题目内容
【题目】I.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

回答下列问题:
(1)甲烷燃料电池负极的电极反应式为________________________。
(2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是________,电解氯化钠溶液的总反应方程式为__________________________。
II.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)

(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2)b电极SO![]() 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________________。
【答案】 CH4-8e-+10OH-===CO![]() +7H2O H2 2Cl-+2H2O
+7H2O H2 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 负 硫酸 SO
Cl2↑+H2↑+2OH- 负 硫酸 SO![]() -2e-+H2O===SO
-2e-+H2O===SO![]() +2H+ H2O
+2H+ H2O![]() H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
【解析】I.(1)在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)b电极与通入甲烷的电极相连,作阴极,是H+放电,生成H2;a连接正极,为阳极,阳极上氯离子放电生成氯气,电解氯化钠溶液的总反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑或2Cl-+2H2O
2NaOH+H2↑+Cl2↑或2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:H2;2NaCl+2H2O
Cl2↑+H2↑+2OH-,故答案为:H2;2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑或2Cl-+2H2O
2NaOH+H2↑+Cl2↑或2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
II.(1)图中可知,钠离子移向a极,亚硫酸根离子移向b极,所以b极为阳极,应该接电源的正极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,故答案为:负;硫酸;
(2)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO32--2e-+H2O=SO42-+2H+;故答案为:SO32--2e-+H2O=SO42-+2H+;
(3)在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2OH++OH-正向移动,所以碱性增强;故答案为:水中存在H2OH++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡向正向移动,碱性增加。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
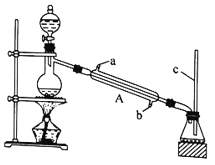
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是_________________,长玻璃管c的作用是__________________________。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________。
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________(按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________。
(3)一定条件下,CO能与NaOH固体发生反应:CO+NaOH ![]() HCOONa。
HCOONa。
①为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0g配制成100mL溶液,量取20.00mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,则产物中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
【题目】用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
阳极 | 阴极 | 溶液甲 | 物质乙 | |
A. | Pt | Pt | NaOH | NaOH固体 |
B. | Pt | Pt | H2SO4 | H2O |
C. | C | Fe | NaCl | 盐酸 |
D. | 粗铜 | 精铜 | CuSO4 | Cu(OH)2 |
A. A B. B C. C D. D
