题目内容
【题目】铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中. 
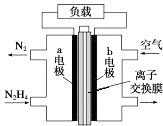
(1)在如图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体.
图 2 装置中铬电极的电极反应式
(2)最近赣州酒驾检查特别严,利用 CrO3 具有强氧化性,有机物(如酒精)遇到 CrO3 时,猛烈反应,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸,从而增强导电性,根据电流大小可自动换算出酒精含量.写出该反应的化学方程式为 .
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀,利用右图装置 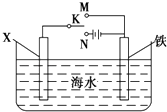 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72﹣发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH﹣结合生成 Fe(OH)3和 Cr(OH)3 沉淀除去,已知某条件下的KspFe(OH)3=3.0×10﹣31 , KspCr(OH)3=6.0×10﹣38 . 已知电解后的溶液中 c(Fe3+)为 2.0×10﹣6 molL1 , 则溶液中 c(Cr3+)=molL﹣1 .
【答案】
(1)NO3﹣+4H++3e﹣=NO↑+2H2O
(2)4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O
(3)N;N或M
(4)4.0×10﹣13
【解析】解:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr为正极、Cu为负极,则Cr和硝酸能产生钝化现象,正极上硝酸根离子得电子发生还原反应生成NO,电极反应式为:NO3﹣+4H++3e﹣=NO↑+2H2O,
所以答案是:NO3﹣+4H++3e﹣=NO↑+2H2O;
(2.)由题目信息可知,CrO3、C2H5OH、H2SO4反应生Cr2(SO4)3、CH3COOH,同时还有水生成,反应方程式为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
所以答案是:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3.)若 X 为碳棒,开关 K 应置于M处,构成原电池,Fe为负极,加速Fe的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
若 X 为锌,开关 K 应置于M处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
所以答案是:N;N或M;(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH﹣)=2.0×10﹣6×c3(OH﹣)=3.0×10﹣31 ,
Ksp[Cr(OH)3]=c(Cr3+)×c3(OH﹣)=6.0×10﹣38
联立可得c(Cr3+)=4.0×10﹣13mol/L,
所以答案是:4.0×10﹣13 .