��Ŀ����
����Ŀ�����������в���ȷ���ǣ� ��
A.һ��Ũ�ȵĴ�������Һ��ʹ��̪��Һ��죬��ԭ���Ƿ��������·�Ӧ��CH3COO��+H2OCH3COOH+OH�� �� ʹ����Һ�е�c��OH������c��H+��
B.�ڳ����£�10 mL 0.2 molL��1������10 mL 0.2 molL��1 Ba��OH��2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20 mL������Һ��pH=13
C.��0.1 molL��1 NH4Cl��Һ�У�c��H+��+c��NH4+=c��Cl����
D.5 mL 1 molL��1 CH3COONa��Һ��5 mL 1 molL��1������Һ��c��Cl����=c��Na+����c��H+����c��OH����
���𰸡�C
���������⣺A����������ǿ��������ˮ�⣬CH3COO��+H2OCH3COOH+OH�� �� ʹ����Һ�е�c��OH������c��H+����������Һ�ʼ��ԣ���ʹ��̪��Һ��죬��A��ȷ��B���ڳ����£�10 mL 0.2 molL��1�����к���0.002molHCl��10 mL 0.2 molL��1 Ba��OH��2��Һ�к���0.002mol������������ֻ�Ϻ������������������Һ������������Ũ��Ϊ�� ![]() =0.1mol/L��������Һ��pH=13����B��ȷ��
=0.1mol/L��������Һ��pH=13����B��ȷ��
C����0.1 molL��1 NH4Cl��Һ�У����ݵ���غ��֪��c��H+��+c��NH4+��=c��Cl����+c��OH��������C����
D.5mL 1 molL��1 CH3COONa��Һ��5 mL 1 molL��1�����ϣ�����Ϊ��Ũ�ȵ�NaCl�ʹ��ᣬ��Һ�����ԣ���Һ������Ũ�ȴ�СΪ��c��Cl����=c��Na+����c��H+����c��OH��������D��ȷ��
��ѡC��

����Ŀ������ͼ�е�ʵ�鷽�����ܴﵽʵ��Ŀ�ĵ���( )
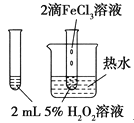
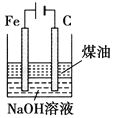
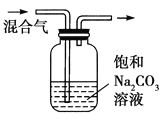
ʵ�鷽�� | ʵ��Ŀ�� | |
A |
| ��֤FeCl3��H2O2�ֽⷴӦ�д����� |
B |
| �Ʊ�Fe(OH)2���ܽϳ�ʱ��۲�����ɫ |
C |
| ��ȥCO2�����л��е�SO2 |
D |
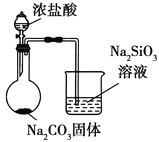
| �Ƚ�HCl��H2CO3��H2SiO3������ǿ�� |
A. A B. B C. C D. D