题目内容
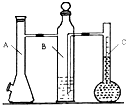 在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)( )
在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)( )| A、102.7 mL | B、112.7 mL | C、92.7 mL | D、122.7 ml |
分析:先根据镁和稀硫酸的物质的量,判断出不足量的是镁,然后镁的物质的量,利用关系式:Mg~H2SO4,计算出生成氢气的物质的量,再根据标况下气体摩尔体积22.4/mol,计算出氢气体积.
解答:解:10mL 2mol/L的硫酸溶液中,硫酸的物质的量是:0.01L×2mol/L=0.02mol,
根据电子守恒找出关系的:Mg~H2SO4,
1 1
物质的量比是1:1,硫酸完全反应,需要金属镁的质量是:0.02×24g=0.48g>0.110g,显然硫酸过量,需要按照不足量的镁进行计算生成氢气的体积,
所以生成氢气的体积是:
×22.4L≈0.102L,
故选A.
根据电子守恒找出关系的:Mg~H2SO4,
1 1
物质的量比是1:1,硫酸完全反应,需要金属镁的质量是:0.02×24g=0.48g>0.110g,显然硫酸过量,需要按照不足量的镁进行计算生成氢气的体积,
所以生成氢气的体积是:
| 0.110 |
| 24 |
故选A.
点评:本题考查了气体摩尔体积的应用,注意先找出不足的量,根据不足量计算出氢气体积,本题难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
|
实验步骤 |
现象 |
结论 |
离子方程式 |
|
第一步 |
取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 |
|
|
|
第二步 |
|
若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 |
|
探究二
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)

(3)装置乙的作用: 。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由__________ __。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
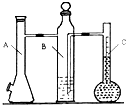 在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)
在标准状况下,用气体摩尔体积测定装置(如图)测定1mol 氢气的体积.镁带的质量为0.110g,实验中注入10mL 2mol/L的硫酸溶液,则在理论上,反应结束后液体量瓶中液体的体积为(忽略抽气体积)