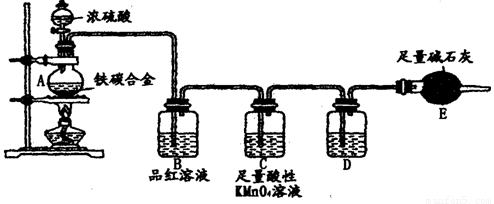
题目内容
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
|
实验步骤 |
现象 |
结论 |
离子方程式 |
|
第一步 |
取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 |
|
|
|
第二步 |
|
若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 |
|
探究二
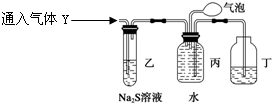
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
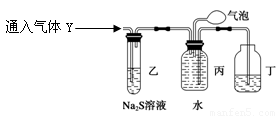
(3)装置乙的作用: 。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由__________ __。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
(1)①反应放热,一段时间后溶液温度升高,反应速率加快;
②由于铁中含杂质铜,反应时形成Fe-Cu 微型原电池,加快反应速率
(2)
|
步骤 |
操作 |
现象与结论 |
可能的离子方程式 |
|
第1步 |
|
若溶液变红色,则溶液含有Fe3+;若无现象,则不含Fe3+ |
Fe3++3SCN-=Fe(SCN)3 |
|
第2步 |
另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 |
|
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
(3)验证NO2的存在并除去NO2
(4)不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO。
(5)1∶3
【解析】
试题分析:(1)①将粗铁粒投入某浓度硝酸中,发现反应进行一段时间后,反应开始逐渐加快,可从2个方面答:其一是温度原因,其二是形成原电池,故答案为:反应放热,一段时间后溶液温度升高,反应速率加快;②由于铁中含杂质铜,反应时形成Fe-Cu微型原电池,加快反应速率;
(2)可以选择硫氰酸钾来检验三价铁离子,存在三价铁离子时,溶液变红色,亚铁离子具有还原性,可以被高锰酸钾氧化为三价铁离子,导致高锰酸钾褪色,故答案为:
|
步骤 |
操作 |
现象与结论 |
可能的离子方程式 |
|
第1步 |
|
若溶液变红色,则溶液含有Fe3+;若无现象,则不含Fe3+ |
Fe3++3SCN-=Fe(SCN)3 |
|
第2步 |
另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 |
|
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
(3)装置乙中NO2与Na2S溶液反应,可看作是先生成硝酸,硝酸在与Na2S溶液反应生成S沉淀,故可验证NO2的存在并除去NO2,故答案为:验证NO2的存在并除去NO2;
(4)由于NO2与水反应也能生成NO,故不能确定气体Y中含NO,可以在乙和丙装置间加一个检验NO2是否除尽装置,故答案为:不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO;
(5)由5NO2-~2 MnO4-,故2n(NO2-)=7.5×10-3 mol,设NO、NO2的物质的量分别为x、y mol,则有:x+y=10×10-3 mol,2x+1/2(y-x)=7.5×10-3,解得:x=2.5×10-3 mol,y=7.5×10-3 mol,气体Y中NO、NO2的体积比为1:3,故答案为:1:3。
考点:探究化学反应机理及物质组成

(15分)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因
_______________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol·L-1 KSCN溶液;0.1 mol·L-1 KI溶液;0.2 mol·L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+。 | |
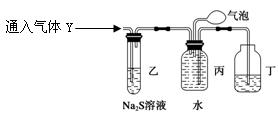
(3)装置乙的作用: 。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定
气体Y中含NO?说明理由。
________________________________________________________________________。
(5) 同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L-1酸性KMnO4溶液滴定,消耗20 mLKMnO4溶液。
则气体Y中NO、NO2的体积比为 。
(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
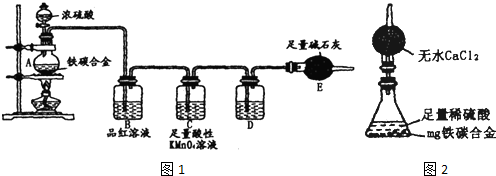
 (2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
(2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动: