题目内容
8.铝粉和氧化铁粉末在高温条件下发生铝热反应,该反应放出大量的热,用于焊接铁轨.反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,对该反应的下列说法正确的是( )| A. | Fe2O3是氧化剂 | B. | 铁元素的化合价升高 | ||
| C. | Fe2O3中铁元素的化合价为+2价 | D. | Fe2O3发生氧化反应 |
分析 反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝由0价升高到+3价,则铝为还原剂,而氧化铁中铁由+3价降低到0价,所以氧化铁为氧化剂,据此分析解答.
解答 解:A、2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝由0价升高到+3价,则铝为还原剂,而氧化铁中铁由+3价降低到0价,所以氧化铁为氧化剂,故A正确;
B、氧化铁中铁由+3价降低到0价,则铁元素的化合价降低,故B错误;
C、Fe2O3中铁元素的化合价为+3价,故C错误;
D、氧化铁中铁由+3价降低到0价,所以氧化铁为氧化剂,发生还原反应,故D错误;
故选:A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中基本概念,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
19.FeCl3溶液与下列物质的反应,其中与Fe3+的水解无关的一组是( )
①紫色石蕊试液
②碘化钾
③煮沸的蒸馏水
④硫化氢
⑤苯酚
⑥铜粉
⑦小苏打溶液
⑧镁粉.
①紫色石蕊试液
②碘化钾
③煮沸的蒸馏水
④硫化氢
⑤苯酚
⑥铜粉
⑦小苏打溶液
⑧镁粉.
| A. | ②④⑤⑥ | B. | ①②④ | C. | ③⑧ | D. | ②④⑧ |
16.能用H++OH-=H2O来表示的化学反应是( )
| A. | Ba(OH)2溶液滴入稀硫酸中 | B. | 氢氧化钠溶液和稀硝酸反应 | ||
| C. | 氢氧化镁和稀盐酸反应 | D. | NaOH溶液滴入醋酸中 |
3.只用一种试剂,可以一次性鉴别NH4Cl、NaCl、Na2SO4三种溶液,这种试剂是( )
| A. | Ba(OH)2溶液 | B. | KCl溶液 | C. | 酚酞溶液 | D. | 盐酸 |
13.家用炒菜锅用水清洗后,出现红棕色的锈斑.此变化过程不发生的化学反应是( )
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 负极反应:Fe-3e-═Fe3+ | D. | 正极反应:2H2O+O2+4e--═4OH- |
20.下列说法错误的是( )
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4-、PO43-也为正四面体结构 | |
| B. | 1 mol金刚石晶体中,平均含有2 mol C-C键 | |
| C. | HF、HCl、HBr、HI的热稳定性从左到右依次减弱 | |
| D. | 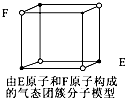 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
17.下列除杂方案中,括号内为除去杂质所需的药品,其中正确的是( )
| A. | NaOH溶液中混有Ba(OH)2 (K2SO4溶液) | B. | O2中混有H2(灼热的氧化铜) | ||
| C. | CO2中混有HCl气体 (NaOH溶液) | D. | Cu粉中混有Al粉(稀盐酸) |
18.下列化学反应的离子方程式正确的是( )
| A. | FeO溶于稀HNO3中 3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | NH4HSO4溶液与少量的NaOH稀溶液的反应:NH4++H++2OH-═H2O+NH3•H2O | |
| C. | Ba(OH)2溶液与NaHSO4溶液的反应溶液呈中性:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2Ba2++4OH-+2SO${\;}_{4}^{2-}$═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O |