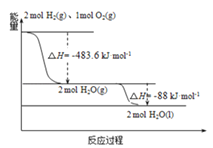
题目内容
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)![]() 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
A. 平衡时,物质的量比A∶B∶C=2∶11∶4
B. x值等于4
C. B的平均反应速率为0.04 mol·L-1·min-1
D. A的转化率20%
【答案】A
【解析】试题分析:根据反应方程式可知:生成0.4 mol C,则消耗A0.2mol;消耗B0.2xmol.则平衡时A的物质的量为0.8mol.B的物质的量为(3-0.2x)mol; 0.4 mol C。0.8+(3-0.2x)+ 0.4=3.4。解得x=4;B正确。平衡时物质的量比A∶B∶C=0.8:(3-0.2x):0.4=4∶11∶2.所以选项A错误。 B的平均反应速率为0.2×4mol÷10L÷2min="0.04" mol·L-1·min-1.因此选项C正确。A的转化率是(0.2mol÷1mol)×100%=20%.所以选项D正确。

练习册系列答案
相关题目