题目内容
7.现有金属单质A、B 和气体甲、乙、丙、丁及物质C、D、E、F、G.其中B是地壳中含量第一的金属,E、F、G中均含有同一种金属元素,气体丁溶于水呈碱性.他们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).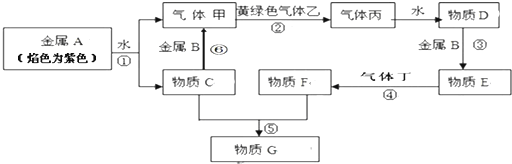
请根据以上信息回答下列问题:
(1)反应①②③④⑤⑥中属于氧化还原反应的是①②③⑥;(填序号)
(2)写出反应⑥的化学方程式:2K+2H2O=2KOH+H2↑;
(3)写出E与G的水溶液混合反应的化学方程式:AlCl3+3KAlO2+6H2O═4Al(OH)3↓+3KCl;
(4)向100mLFeBr2的溶液中通入1.12L标准状况下黄绿色气体乙,最后知溶液中有四分之一的Br-被氧化成Br2,则原FeBr2的溶液中FeBr2的物质的量浓度为0.67mol/L.(小数点后保留两位有效数字)
分析 金属A焰色反应为紫色证明为K,与水反应生成气体甲为H2,物质C为KOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,氢气和氯气反应生成气体丙为HCl,溶于水得到溶液D为盐酸溶液;铝和盐酸反应生成物质E为AlCl3,气体丁溶于水呈碱性,丁为NH3,氨气与氯化铝溶液反应生成物质F为Al(OH)3,氢氧化钾和氢氧化钾反应生成G为KAlO2,据此答题.
解答 解:金属A焰色反应为紫色证明为K,与水反应生成气体甲为H2,物质C为KOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,氢气和氯气反应生成气体丙为HCl,溶于水得到溶液D为盐酸溶液;铝和盐酸反应生成物质E为AlCl3,气体丁溶于水呈碱性,丁为NH3,氨气与氯化铝溶液反应生成物质F为Al(OH)3,氢氧化钾和氢氧化钾反应生成G为KAlO2,
(1)在反应①②③④⑤⑥中,反应①为钾与水反应生成氢气,反应②为氢气与氯气反应生成氯化氢,反应③为盐酸与铝的反应,反应⑥为铝与氢氧化钾的反应,这些都属于氧化还原反应,
故答案为:①②③⑥;
(2)反应⑥的化学方程式为2K+2H2O=2KOH+H2↑,
故答案为:2K+2H2O=2KOH+H2↑;
(3)氯化铝与偏铝酸钾发生双水解生成氢氧化铝,反应的化学方程式为AlCl3+3KAlO2+6H2O═4Al(OH)3↓+3KCl,
故答案为:AlCl3+3KAlO2+6H2O═4Al(OH)3↓+3KCl;
(4)向100mLFeBr2的溶液中通入1.12L标准状况下氯气即为0.05mol,氯气先氧化亚铁离子,然后氧化溴离子,设溶液中FeBr2的物质的量为amol,最后知溶液中有四分之一的Br-被氧化成Br2,根据电子得失守恒有$\frac{1}{2}$a+a=0.05×2,则a=$\frac{1}{15}$,则原FeBr2的溶液中FeBr2的物质的量浓度为$\frac{\frac{1}{15}}{0.1}$ mol/L=0.67mol/L,
故答案为:0.67.
点评 本题考查无机物的推断,题目难度中等,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.

| A. | 同温度、同体积的N2和O2 | B. | 同压强、同体积的H2和CH4 | ||
| C. | 同质量、不同密度的N2和CO | D. | 同体积、同密度的CO2和N2 |
| A. | 氢氧化钠的摩尔质量为40g | |
| B. | 1摩尔氧原子的质量就是氧的相对原子质量 | |
| C. | H2SO4的摩尔质量为96g•mol-1 | |
| D. | 1molCO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |
| A. | 鉴别SO42-加入BaC12溶液,再加稀盐酸,观察沉淀是否消失 | |
| B. | 证明CH2=CHCH2CHO中一定碳酸不饱和键:滴入KMnO4酸性溶液看紫红色是否褪去 | |
| C. | 量取14.80mL 1.000mol•L-1NaOH溶液选用25mL碱式滴定管 | |
| D. | 检验溶液中一定有CO32-:加入稀盐酸,将产生的气体通入澄清石灰水 |
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
 某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整. Al3+; 碳酸氢根离子HCO3-;次氯酸钙Ca(ClO)2
Al3+; 碳酸氢根离子HCO3-;次氯酸钙Ca(ClO)2