题目内容
19.现有Na2CO3和NaCl固体混合物22.3g,完全溶于水配成500mL溶液,向其中加入足量的CaCl2溶液,得到一定量的白色沉淀.用过量的稀HNO3处理该白色沉淀,得到标况下的气体2.24L,计算原混合溶液中NaCl的物质的量浓度.分析 生成的气体为二氧化碳,根据碳原子守恒可计算出碳酸钠的物质的量,再根据m=nM碳酸钠的质量,从而可知混合物中氯化钠的质量,然后根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算出氯化钠的浓度.
解答 解:生成的白色沉淀为碳酸钙,碳酸钙与稀硝酸反应生成二氧化碳气体,根据碳原子守恒可知:n(Na2CO3)=n(CaCO3)=n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
则原混合物中碳酸钠的质量为:106g/mol×0.1mol=10.6g,
所以混合物中氯化钠的物质的量为:n(NaCl)=$\frac{22.3g-10.6g}{58.5g/mol}$=0.2mol,
原混合溶液中NaCl的物质的量浓度为:c(NaCl)=$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:原混合溶液中NaCl的物质的量浓度为0.4mol/L.
点评 本题考查了混合物反应的计算、物质的量浓度的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.在1.00L 1mol/L氢氧化钠溶液中通入16.8L标准状况下的CO2气体,所得的溶液中含有的溶质是( )
| A. | Na2CO3 | B. | NaHCO3 | ||
| C. | Na2CO3和NaHCO3 | D. | NaOH、Na2CO3和NaHCO3 |
10.以下说法中,正确的是( )
| A. | 0.3 mol•L-1 K2SO4溶液中含有0.6NA个K+和0.3 mol的SO42- | |
| B. | 在标准状况下H2O的摩尔体积约是22.4 L•mol-1 | |
| C. | 将58.5g的NaCl固体溶解在1L的水中,所得的溶液物质的量浓度为1mol/L | |
| D. | 1 mol任何气体在标准状况下的体积都约为22.4 L |
14.分子式为C6H12O且能发生银镜反应的有机化合物有(不考虑立体异构)( )
| A. | 5 种 | B. | 6种 | C. | 7种 | D. | 8种 |
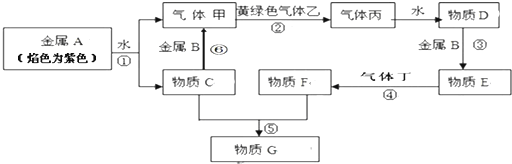
4.M、N、X、Y四种物质之间有如下转化关系(反应条件和其它产物已略去).下列选项不符合的是( )
M$→_{反应①}^{+X}$N$→_{反应②}^{+X}$Y.
M$→_{反应①}^{+X}$N$→_{反应②}^{+X}$Y.
| A. | M:N2 X:O2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:NO X:O2 |
 (1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
(1)某可逆反应(ABC均为气体)从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
 ,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是
,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是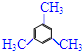 (写结构简式).
(写结构简式).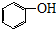 +nHCHO$→_{△}^{催化剂}$
+nHCHO$→_{△}^{催化剂}$ +nH2O.
+nH2O. G:
G: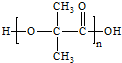 .
.