题目内容
(6分)在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
0.1;6.5;0.5
(1)在铜锌原电池中,锌作为负极,失去电子,发生氧化反应,反应式是Zn-2e-=Zn2+。铜左正极,溶液中的氢离子得到电子,发生还原反应,反应式是2H++2e-=H2↑。2.24L氢气恰好是0.1mol,所以转移的电子是0.1mol×2=0.2mol。
(2)根据得失电子守恒可知,溶解的锌的物质的量是0.1mol,质量是0.1mol×65g/mol=6.5g。
(3)根据原子守恒可知,原硫酸的物质的量是0.1mol,所以其浓度是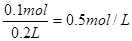 。
。
(2)根据得失电子守恒可知,溶解的锌的物质的量是0.1mol,质量是0.1mol×65g/mol=6.5g。
(3)根据原子守恒可知,原硫酸的物质的量是0.1mol,所以其浓度是
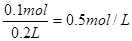 。
。
练习册系列答案
相关题目
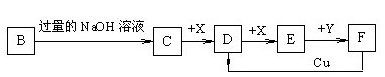
 N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。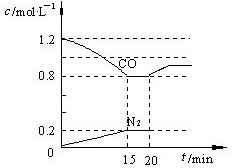
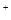 +2e
+2e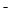 =H
=H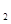 ↑
↑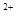 +2e=Fe
+2e=Fe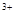 e
e