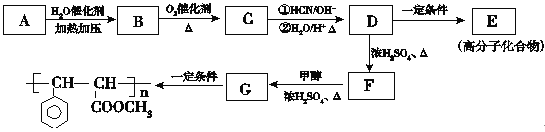
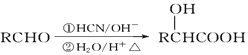题目内容
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
【答案】 bdef 防止硝酸银见光分解 0.508%或0.51% H2O2+I-=H2O+IO- H2O2+IO-=H2O+O2↑+I- 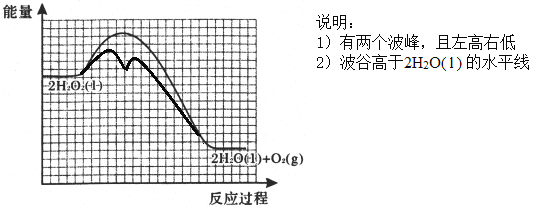 室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
【解析】(1)①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是三脚架、泥三角、酒精灯、坩埚钳,答案选 bdef;②防止硝酸银见光分解,所以使用棕色滴定管;③根据表中数据可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×500mL/100mL=0.001mol,说明25.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:127g/mol×0.001mol/25.00g×100%=0.508%;(2)①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,则第一步消耗碘离子,第二步又产生碘离子,依次发生反应的离子方程式为H2O2+I-=H2O+IO-、H2O2+IO-=H2O+O2↑+I-;②由于催化剂降低反应的活化能,但不能改变焓变。又因为反应甲为吸热反应,且甲的反应速率小于乙的反应速率,所以反应过程的能量变化图为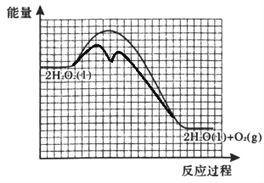 。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。
。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案